早教吧作业答案频道 -->化学-->
实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图:(1)①写出铜帽溶解过程中铜发生反应的化学方程式.②铜帽溶解后需将溶液中过量H2O2除去.
题目详情
实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图:
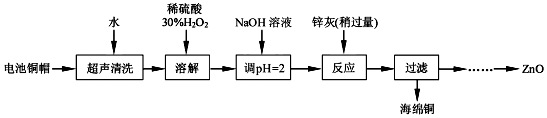
(1)①写出铜帽溶解过程中铜发生反应的化学方程式___.
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是___.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH至3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为___,滴定终点观察到的现象为___.
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会___(填“偏高”、“偏低”、“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
由回收铜后的滤液制备ZnO的实验步骤依次为:
①向滤液中加入略过量___,使其充分反应
②向反应后的溶液中滴加1.0moL•L-1的NaOH溶液,调节溶液的pH
范围为___;
③过滤;
④向滤液中滴加1.0moL•L-1的氢氧化钠,调节pH范围为___;
⑤过滤、洗涤、干燥
⑥900℃煅烧.

(1)①写出铜帽溶解过程中铜发生反应的化学方程式___.
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是___.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH至3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为___,滴定终点观察到的现象为___.
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会___(填“偏高”、“偏低”、“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
由回收铜后的滤液制备ZnO的实验步骤依次为:
①向滤液中加入略过量___,使其充分反应
②向反应后的溶液中滴加1.0moL•L-1的NaOH溶液,调节溶液的pH
范围为___;
③过滤;
④向滤液中滴加1.0moL•L-1的氢氧化钠,调节pH范围为___;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
▼优质解答
答案和解析
(1)①铜帽溶解过程中铜发生反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
②过氧化氢性质比较稳定,若加热到153℃便猛烈的分解为水和氧气,将溶液中过量的H2O2 除去可加热至沸;
故答案为:加热(至沸腾);
(2)①淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,且半分钟内不恢复,说明滴定到达终点;
故答案为:淀粉溶液;溶液蓝色褪去,且半分钟内不恢复;
②若留有H2O2,加入KI后,会有以下反应:H2O2+2I-+2H+=I2+2H2O,误当成2Cu2++4I-=2CuI(白色)↓+I2 生成的碘,使测定结果偏高;
故答案为:偏高;
(3)根据表中阳离子沉淀的PH可知,由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入略微过量的30%H2O2,使其充分反应,目的使Fe2+转化完全为Fe3+,②加氢氧化钠溶液,控制PH在3.2~5.9,使Fe3+沉淀完全,③过滤,向滤液中滴加1.0mol•L-1NaOH,调节溶液PH8.9~11,使Zn2+沉淀完全,⑤过滤、洗涤、干燥⑥900℃煅烧,制得氧化锌;
故答案为:①30%的H2O2;②3.2~5.9;④8.9~11.
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
②过氧化氢性质比较稳定,若加热到153℃便猛烈的分解为水和氧气,将溶液中过量的H2O2 除去可加热至沸;
故答案为:加热(至沸腾);
(2)①淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,且半分钟内不恢复,说明滴定到达终点;
故答案为:淀粉溶液;溶液蓝色褪去,且半分钟内不恢复;
②若留有H2O2,加入KI后,会有以下反应:H2O2+2I-+2H+=I2+2H2O,误当成2Cu2++4I-=2CuI(白色)↓+I2 生成的碘,使测定结果偏高;
故答案为:偏高;
(3)根据表中阳离子沉淀的PH可知,由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入略微过量的30%H2O2,使其充分反应,目的使Fe2+转化完全为Fe3+,②加氢氧化钠溶液,控制PH在3.2~5.9,使Fe3+沉淀完全,③过滤,向滤液中滴加1.0mol•L-1NaOH,调节溶液PH8.9~11,使Zn2+沉淀完全,⑤过滤、洗涤、干燥⑥900℃煅烧,制得氧化锌;
故答案为:①30%的H2O2;②3.2~5.9;④8.9~11.
看了实验室利用废弃旧电池的铜帽(Z...的网友还看了以下:
如图所示,在O点放置一个正电荷,在过O点的竖直平面内的A点自由释放一个带正电的小球,小球的质量为m 2020-05-17 …
CPU与通道可以并行执行,并通过______实现彼此之间的通信和同步。A.I/O指令B.I/O中断C 2020-05-23 …
CPU程序和通道程序可以并行执行,并通过( )实现彼此间的通讯和同步。A.I/O指令B.I/O中断C 2020-05-23 …
对于如图1-4所示的UML类图,正确的描述是(47)。A.类O的实例中包含了对类P的实例的引用B.类 2020-05-26 …
在具有n个结点的单链表中,实现下列哪些操作,其算法的时间复杂度都是O(n)?a)遍历链表和求链表的 2020-06-12 …
如图所示,质量为m(可视为质点)的小球P,用两根轻绳OP和O'P在P点拴结实后再分别系与竖直墙上且 2020-06-19 …
如图所示,已知线段MN,若用尺规作图作出MN的中点O,然后再取OM的中点A,然后分别以O、A为圆心 2020-07-24 …
如图所示,虚线a、b、c表示O处点电荷的电场中的三个等势面,设两相邻等势面的间距相等,一电子射入电场 2020-10-31 …
1.若集合A={x|(a-1)x^2+2x+1=o}中只含有一个元素,求实数a2.已知集合A={1, 2020-12-07 …
、如图所示,使一束激光射至空水槽中的O点,然后慢慢向水槽中注水:(1)水槽中的光斑向(左/右)移动; 2021-01-13 …