早教吧作业答案频道 -->化学-->
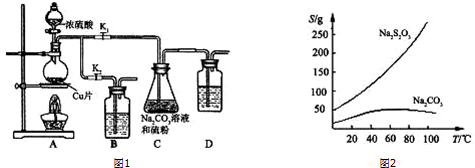
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1.已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示.(1)Na2S2O3•5H2O的制备:步骤1:打开K1
题目详情
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1.已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示.
(1)Na2S2O3•5H2O的制备:
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热.写出烧瓶内发生反应的化学方程式:___.
步骤2:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH___时,打开K2、关闭K1并停止加热,理由是___.装置B、D的作用是___.
步骤3:过滤C中的混合液,将滤液经过___、___、过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:
向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性.该方案是否正确并说明理由___.
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010mol•L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为①Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;②I2+2S2O32-═2I-+S4O62-.
则该废水中Ba2+的物质的量浓度为___.

(1)Na2S2O3•5H2O的制备:
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热.写出烧瓶内发生反应的化学方程式:___.
步骤2:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH___时,打开K2、关闭K1并停止加热,理由是___.装置B、D的作用是___.
步骤3:过滤C中的混合液,将滤液经过___、___、过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:
向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性.该方案是否正确并说明理由___.
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010mol•L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为①Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;②I2+2S2O32-═2I-+S4O62-.
则该废水中Ba2+的物质的量浓度为___.
▼优质解答
答案和解析
(1)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑;由于Na2S2O3在酸性溶液中不能稳定存在,碳酸钠的作用是起反应物作用及提供碱性环境,所以当C中溶液的pH接近7时,打开K2、关闭K1并停止加热;SO2是大气污染物,需要尾气处理,则装置B、D中应盛放氢氧化钠溶液,用来吸收SO2,防止污染环境;Na2S2O3•5H2O受热易分解,所需冷却结晶,所以从滤液中获取Na2S2O3•5H2O需蒸发浓缩冷却结晶等操作,
故答案为:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑;接近7;Na2S2O3在酸性溶液中不能稳定存在;吸收SO2,防止污染;蒸发浓缩;冷却结晶;
(2)因为氯水中氯气和水反应生成盐酸和次氯酸,氯水中一定有氯离子,所以加入硝酸银生成沉淀,不能证明因Na2S2O3具有还原性,氯离子是氯气做氧化剂生成的,
故答案为:不正确,因为氯水中含有Cl-;
(3)溶液中发生的反应为:2Ba2++Cr2O72-=2BaCrO4+2H+、Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-;
根据方程式列出各物质的关系为Ba2+~BaCrO4~
Cr2O72-~
I2~3S2O32-
1mol 3mol
则n(Ba2+)=3n(S2O32-)=
×0.0100mol•L-1×18.00×10-3 L=6×10-5mol,所以c(Ba2+)═
=2.4×10-3mol•L-1,
故答案为:2.4×10-3 mol•L-1.
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(2)因为氯水中氯气和水反应生成盐酸和次氯酸,氯水中一定有氯离子,所以加入硝酸银生成沉淀,不能证明因Na2S2O3具有还原性,氯离子是氯气做氧化剂生成的,
故答案为:不正确,因为氯水中含有Cl-;
(3)溶液中发生的反应为:2Ba2++Cr2O72-=2BaCrO4+2H+、Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-;
根据方程式列出各物质的关系为Ba2+~BaCrO4~
| 1 |
| 2 |
| 3 |
| 2 |
1mol 3mol
则n(Ba2+)=3n(S2O32-)=
| 1 |
| 3 |
| 6×10 -5mol |
| 25.00×10 -3L |
故答案为:2.4×10-3 mol•L-1.
看了硫代硫酸钠(Na2S2O3)可...的网友还看了以下:
将18.0mol•L-1的浓硫酸稀释成100mL2.00mol•L-1的稀硫酸,下列操作会导致所配 2020-04-12 …
硫化钾K2S,钾是固定的是+1价,但硫不是固定的啊有硫化钾K2S,钾是固定的是+1价,但硫不是固定 2020-05-16 …
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被 2020-06-10 …
某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%。现 2020-07-21 …
现有硫酸铝和硫酸锌两种盐,试回答下列问题:1:0.5摩尔硫酸铝中所含的铝离子的个数是多少?2:1摩 2020-07-22 …
(2014•莆田)有人用经过粉碎的含较多有机物杂质的粗铜,通过如图1步骤制取硫酸铜晶体.(1)若步骤 2020-11-12 …
Fe2+不稳定,在空气中很容易被氧化成Fe3+.现有一瓶硫酸亚铁片剂,请利用实验室的常见试剂与用品, 2020-12-04 …
氯掩蔽剂:10g硫酸汞溶于1:10稀硫酸定容到100ml(1:10稀硫酸是指10ml浓硫酸100ml 2020-12-26 …
求硫酸铜块状结晶的方法,用硫酸铜饱和溶液做块状结晶,再次形成松果状块状结晶,很少有规则的形状.实验步 2020-12-29 …
SO2是硫酸工业尾气的主要成分。实验室中,拟用如图所示流程,测定标准状况下体积为VL的硫酸工业尾气中 2021-02-01 …