早教吧作业答案频道 -->化学-->
某校化学甲、乙两个小组学生利用下图所列装置进行“铁与水反应及相关性质”的实验.(图中夹持及尾气处理装置均已略去)(1)烧瓶底部放置了几片碎瓷片,碎资片的作用是.装置B
题目详情
某校化学甲、乙两个小组学生利用下图所列装置进行“铁与水反应及相关性质”的实验.(图中夹持及尾气处理装置均已略去)
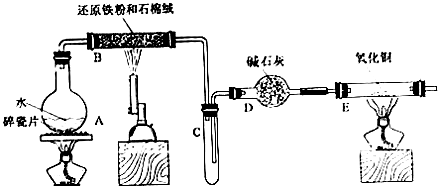
(1)烧瓶底部放置了几片碎瓷片,碎资片的作用是___.装置B中发生反应的化学方程式是___.
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行___装置中的现象是___.
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
①乙组得到的黑色粉末是___.
②甲组步骤1中反应的离子方程式为___.
③乙组步骤4中,溶液变红的原因为___;溶液褪色可能的原因是___;验证方法为___.
(4)其中一组同学将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200mL.5mol•L-1FeSO4溶液和5.2g固体沉淀物,则原Fe2(SO4)3溶液的物质的量浓度为___;将沉淀物过滤后,该组同学又向清液中滴加稀硝酸,观察到有NO气体生成,发生的化学反应方程式为___.

(1)烧瓶底部放置了几片碎瓷片,碎资片的作用是___.装置B中发生反应的化学方程式是___.
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行___装置中的现象是___.
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
| 步骤 | 操作 | 甲组现象 | 乙组现象 | |
| 1 | 取黑色粉末加入稀盐酸 | 洛解,无气泡 | 溶解,无气泡 | |
| 2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 | |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 | |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 | |
②甲组步骤1中反应的离子方程式为___.
③乙组步骤4中,溶液变红的原因为___;溶液褪色可能的原因是___;验证方法为___.
(4)其中一组同学将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200mL.5mol•L-1FeSO4溶液和5.2g固体沉淀物,则原Fe2(SO4)3溶液的物质的量浓度为___;将沉淀物过滤后,该组同学又向清液中滴加稀硝酸,观察到有NO气体生成,发生的化学反应方程式为___.
▼优质解答
答案和解析
(1)加热纯液体时加入碎瓷片,可防止暴沸,铁与水蒸气反应生成四氧化三铁和氢气,方程式为3Fe+4H2O(g)
4H2+Fe3O4,
故答案为:防爆沸;3Fe+4H2O(g)
4H2+Fe3O4;
(2)氢气在点燃时应先验纯,防止不纯的氢气爆炸,氢气与氧化铜发生置换反应,可观察到黑色变为紫红色,故答案为:验纯;黑色变为紫红色;
(3)①乙组加入盐酸后,在加入KSCN不变红,说明不含铁离子,则生成黑色固体为FeO,故答案为:FeO;
②甲组加入盐酸溶解后,分别加入KSCN变红,说明含有铁离子,加入高锰酸钾褪色,说明含有亚铁离子,说明甲组生成Fe3O4,加入盐酸,发生Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
③乙组步骤4加入氯水,发生Cl2+2Fe2+=2Fe3++2Cl-,KSCN与铁离子发生Fe3++SCN-=FeSCN2+,两组实验滴加氯水,都出现红色褪去,可说明氯气氧化SCN-,如验证,可继续向溶液中滴入KSCN溶液,溶液变红即可证明,
故答案为:Cl2+2Fe2+=2Fe3++2Cl-,Fe3++SCN-=FeSCN2+;氯水将SCN-氧化破坏了;继续向溶液中滴入KSCN溶液,溶液变红即可证明;
(4)溶液中含有Fe2+:0.5mol•L-1×0.2L=0.1mol<
,
∴6g铁粉过量,设反应消耗铁的物质的量为x,生成铜的物质的量为y,
Fe+Fe2 (SO4)3=3FeSO4
1mol 1mol 3mol
xmol xmol 3xmol
Fe+CuSO4=FeSO4+Cu
1mol 1mol 1mol 1mol
ymol ymol ymol ymol
可得
,
解得x=0.02mol、y=0.04mol,
原溶液中Fe2(SO4)3物质的量浓度为
=0.1mol/L,
该组同学又向清液中滴加稀硝酸,观察到有NO气体生成,说明硝酸氧化亚铁离子,方程式为6FeSO4+8HNO3=2Fe2(SO4)3+2NO↑+4H2O+2Fe(NO3)3,
故答案为:0.1mol/L; 6FeSO4+8HNO3=2Fe2(SO4)3+2NO↑+4H2O+2Fe(NO3)3.
| ||
故答案为:防爆沸;3Fe+4H2O(g)
| ||
(2)氢气在点燃时应先验纯,防止不纯的氢气爆炸,氢气与氧化铜发生置换反应,可观察到黑色变为紫红色,故答案为:验纯;黑色变为紫红色;
(3)①乙组加入盐酸后,在加入KSCN不变红,说明不含铁离子,则生成黑色固体为FeO,故答案为:FeO;
②甲组加入盐酸溶解后,分别加入KSCN变红,说明含有铁离子,加入高锰酸钾褪色,说明含有亚铁离子,说明甲组生成Fe3O4,加入盐酸,发生Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
③乙组步骤4加入氯水,发生Cl2+2Fe2+=2Fe3++2Cl-,KSCN与铁离子发生Fe3++SCN-=FeSCN2+,两组实验滴加氯水,都出现红色褪去,可说明氯气氧化SCN-,如验证,可继续向溶液中滴入KSCN溶液,溶液变红即可证明,
故答案为:Cl2+2Fe2+=2Fe3++2Cl-,Fe3++SCN-=FeSCN2+;氯水将SCN-氧化破坏了;继续向溶液中滴入KSCN溶液,溶液变红即可证明;
(4)溶液中含有Fe2+:0.5mol•L-1×0.2L=0.1mol<
| 6g |
| 56g/mol |
∴6g铁粉过量,设反应消耗铁的物质的量为x,生成铜的物质的量为y,
Fe+Fe2 (SO4)3=3FeSO4
1mol 1mol 3mol
xmol xmol 3xmol
Fe+CuSO4=FeSO4+Cu
1mol 1mol 1mol 1mol
ymol ymol ymol ymol
可得
|
解得x=0.02mol、y=0.04mol,
原溶液中Fe2(SO4)3物质的量浓度为
| 0.02mol |
| 0.2L |
该组同学又向清液中滴加稀硝酸,观察到有NO气体生成,说明硝酸氧化亚铁离子,方程式为6FeSO4+8HNO3=2Fe2(SO4)3+2NO↑+4H2O+2Fe(NO3)3,
故答案为:0.1mol/L; 6FeSO4+8HNO3=2Fe2(SO4)3+2NO↑+4H2O+2Fe(NO3)3.
看了某校化学甲、乙两个小组学生利用...的网友还看了以下:
省略是去掉还是四舍五入一个数省略尾数,是去掉尾数,还是四舍五入?例如785412,省略万后面的尾数 2020-06-03 …
甲公司兼并乙公司的策略属于()。 A.前向一体化战略 B.后向一体化战略 C.多元化战略 2020-06-05 …
甲、乙两船长度均为10米,沿同一方向匀速划行.甲船在前,速度为8米/秒,在乙船追上并超过甲船的过程 2020-06-15 …
甲、乙两缸内共有金鱼若干尾,其中甲缸中金鱼的尾数占两缸金鱼总数的百分之六十,现在从甲缸内取出12尾 2020-07-11 …
甲酸甲酯水解反应方程式为:HCOOCH3+H2OHCOOH+CH3OH–Q(Q>0)某小组通过实验 2020-07-24 …
甲酸甲酯水解反应方程式为:HCOOCH3+H2O⇌HCOOH+CH3OH-Q(Q>0)某小组通过实 2020-07-24 …
(2013•连云港一模)实验化学苯甲酸常用于抗真菌及消毒防腐.实验室常用高锰酸钾氧化甲苯制备苯甲酸, 2020-11-12 …
企业战略管理名词解释!17成本领先战略18差异化战略19集中化战略20相关多元化战略21协同效应22 2020-12-21 …
甲酸甲酯水解反应方程式为:HCOOCH3+H2OHCOOH+CH3OH–Q(Q>0)某小组通过实验研 2020-12-25 …
甲酸甲酯水解反应方程式为:某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的 2020-12-25 …