早教吧作业答案频道 -->化学-->
教材中制取氯气的方法如下:(1)电解法制氯气:观察如图1,回答:①此反应化学方程式为.②若饱和食盐水中含有酚酞,通电后(填“铁棒”或“石墨棒”)附近变红.图中b端产生
题目详情
教材中制取氯气的方法如下:
(1)电解法制氯气:观察如图1,回答:
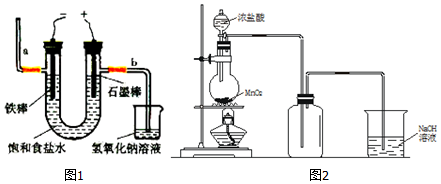
①此反应化学方程式为___.
②若饱和食盐水中含有酚酞,通电后___(填“铁棒”或“石墨棒”)附近变红.图中b端产生的气体如用湿润的淀粉-KI试纸检验,其现象为___.
(2)实验室也可以用加热MnO2和浓盐酸制取Cl2,如图2
①盛装浓盐酸的仪器名称为___;
②若要收集纯净且干燥的Cl2,此装置还应依次加入的试剂为___;
③NaOH溶液的作用是___,发生反应的化学方程式是___;
④实验室用下列两种方法制氯气:I、用含HCl 146g的浓盐酸与足量的MnO2反应;
II、用87gMnO2与足量浓盐酸反应.所得的氯气___
A. I比 II多 B. II比 I多 C.一样多 D.无法比较
⑤将Cl2溶于水得到新制的氯水,用玻璃棒蘸取新制的氯水,滴在pH试纸上,现象为___.
(1)电解法制氯气:观察如图1,回答:

①此反应化学方程式为___.
②若饱和食盐水中含有酚酞,通电后___(填“铁棒”或“石墨棒”)附近变红.图中b端产生的气体如用湿润的淀粉-KI试纸检验,其现象为___.
(2)实验室也可以用加热MnO2和浓盐酸制取Cl2,如图2
①盛装浓盐酸的仪器名称为___;
②若要收集纯净且干燥的Cl2,此装置还应依次加入的试剂为___;
③NaOH溶液的作用是___,发生反应的化学方程式是___;
④实验室用下列两种方法制氯气:I、用含HCl 146g的浓盐酸与足量的MnO2反应;
II、用87gMnO2与足量浓盐酸反应.所得的氯气___
A. I比 II多 B. II比 I多 C.一样多 D.无法比较
⑤将Cl2溶于水得到新制的氯水,用玻璃棒蘸取新制的氯水,滴在pH试纸上,现象为___.
▼优质解答
答案和解析
(1)电解法制氯气,是电解食盐水生成氢氧化钠、氢气、氯气,在电解池的阳极产生氯气,阴极产生氢气,同时有氢氧化钠产生,
①电解反应的化学方程式为 2NaCl+2H2O
2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑;
②电解食盐水时,铁做阴极,石墨棒做阳极,氢氧化钠在阴极即铁棒附近产生,所以通电后铁棒附近变红,图中b端产生氯气,检验氯气的方法是用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气,故答案为:铁棒;试纸变蓝;
(2)①根据装置图,盛装浓盐酸的仪器名称为分液漏斗,故答案为:分液漏斗;
②浓盐酸易挥发,加热制备的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯化氢,浓硫酸具有吸水性,可以干燥氯气;
故答案为:饱和食盐水、浓硫酸;
③NaOH溶液的作用收集尾气,发生化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:收集尾气;Cl2+2NaOH=NaCl+NaClO+H2O;
④反应化学方程式为MnO2+4HCl
MnCl2+Cl2↑+2H2O;
理论计算:Ⅰ、含HCl146g的浓盐酸与足量的MnO2反应,4HCl~Cl2,可得氯气1mol,但随盐酸浓度变稀,溶质HCl不可能全部反应,故实际生成氯气应小于1mol;
Ⅱ、用87gMnO2与足量浓盐酸反应,因为浓盐酸足量,可以使87gMnO2全部反应,故生成氯气为1mol;所以II比 I多;
故选B;
⑤氯气可与水反应生成盐酸和次氯酸,其中盐酸可使pH变成红色,次氯酸具有强氧化性,可漂白试纸,最后使试纸褪色.
故答案为:试纸先变红后褪色.
①电解反应的化学方程式为 2NaCl+2H2O
| ||
| ||
②电解食盐水时,铁做阴极,石墨棒做阳极,氢氧化钠在阴极即铁棒附近产生,所以通电后铁棒附近变红,图中b端产生氯气,检验氯气的方法是用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气,故答案为:铁棒;试纸变蓝;
(2)①根据装置图,盛装浓盐酸的仪器名称为分液漏斗,故答案为:分液漏斗;
②浓盐酸易挥发,加热制备的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯化氢,浓硫酸具有吸水性,可以干燥氯气;
故答案为:饱和食盐水、浓硫酸;
③NaOH溶液的作用收集尾气,发生化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:收集尾气;Cl2+2NaOH=NaCl+NaClO+H2O;
④反应化学方程式为MnO2+4HCl
| ||
理论计算:Ⅰ、含HCl146g的浓盐酸与足量的MnO2反应,4HCl~Cl2,可得氯气1mol,但随盐酸浓度变稀,溶质HCl不可能全部反应,故实际生成氯气应小于1mol;
Ⅱ、用87gMnO2与足量浓盐酸反应,因为浓盐酸足量,可以使87gMnO2全部反应,故生成氯气为1mol;所以II比 I多;
故选B;
⑤氯气可与水反应生成盐酸和次氯酸,其中盐酸可使pH变成红色,次氯酸具有强氧化性,可漂白试纸,最后使试纸褪色.
故答案为:试纸先变红后褪色.
看了 教材中制取氯气的方法如下:(...的网友还看了以下:
苯酚与水混合后,如何提取苯酚 2020-06-05 …
氢氧化钠加酚酞加稀盐酸取1支试管加入约2毫米的氢氧化钠,再加1到2滴酚酞试管摇匀后再用焦头滴管逐滴 2020-06-05 …
1,酚的羟基能否与卤氢酸的取代反应,为什么2,羧基上的羟基能否与卤氢酸发生取代反应,为什么 2020-06-28 …
矩阵(10)的秩是2,书上说他的一阶子式为零,2阶子式不为零.(01)请问,按照定义,子式是任取K 2020-06-30 …
酚酞是常用的酸碱指示剂,其结构简式如下所示:(1)酚酞的分子式为:。(2)从结构上看酚酞可看作。A 2020-07-29 …
苯酚钠制取苯酚、FeCl3制取Fe2O3(请用化学方程式说明) 2020-07-29 …
某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图如图所示:请填写下列空白:( 2020-07-29 …
某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图如图所示:请填写下列空白:( 2020-07-29 …
0.1%酚酞溶液与0.5%酚酞溶液有啥区别?在做指示剂时可以用0.1%酚酞代替0.1%酚酞吗? 2020-11-23 …
酚酞是常用的酸碱指示剂,其结构简式如下所示:(1)酚酞的分子式为:。(2)从结构上看酚酞可看作 2020-11-26 …