早教吧作业答案频道 -->化学-->
硫酸亚铁晶体(FeSO4•7H2O)在医药上做补血剂,聚合硫酸铁[Fe2(OH)n(SO4)(3-n2)]m是高效的水处理混凝剂,在实验窒以铁屑和稀硫酸为主要原料.制备它们的实验方案
题目详情
硫酸亚铁晶体(FeSO4•7H2O)在医药上做补血剂,聚合硫酸铁[Fe2(OH)n(SO4)(3-
)]m是高效的水处理混凝剂,在实验窒以铁屑和稀硫酸为主要原料.制备它们的实验方案如下;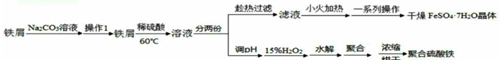
已知:所得聚合硫酸铁产品若能用于饮用水处理.需达到盐基度指际在8.0%~16.0%范围内.盐基度是指产品中n(OH-)、n(Fe3+) 的比值,即盐基度=n(OH-)/n(Fe3+)×100%
(1)操作1的名称是___.
(2)聚合硫酸铁的盐基度的测定:
①称取a g聚合硫酸铁产品溶于足量的盐酸中,溶液均分两等份.
②向一份中加入足量的铜片,充分反应后铜片减轻4.48g.
③向另一份中滴加足量的BaCl2溶液,得到干燥的沉淀46.6g.
则该产品的盐基度为___(保留三位有效数字).
| n |
| 2 |

已知:所得聚合硫酸铁产品若能用于饮用水处理.需达到盐基度指际在8.0%~16.0%范围内.盐基度是指产品中n(OH-)、n(Fe3+) 的比值,即盐基度=n(OH-)/n(Fe3+)×100%
(1)操作1的名称是___.
(2)聚合硫酸铁的盐基度的测定:
①称取a g聚合硫酸铁产品溶于足量的盐酸中,溶液均分两等份.
②向一份中加入足量的铜片,充分反应后铜片减轻4.48g.
③向另一份中滴加足量的BaCl2溶液,得到干燥的沉淀46.6g.
则该产品的盐基度为___(保留三位有效数字).
▼优质解答
答案和解析
铁屑在碳酸钠溶液中除去表面的油脂,过滤后得到铁屑加入稀硫酸加热反应得到溶液分为两份,趁热过滤得到滤液小火加热蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸亚铁晶体,另一份调节溶液PH,加入过氧化氢溶液氧化亚铁离子生成铁离子,水解聚合浓缩烘干得到聚合硫酸铁,
(1)上述分析可知,操作1为过滤操作,故答案为:过滤;
(2)盐基度是指产品中n(OH-)、n(Fe3+) 的比值,即盐基度=n(OH-)/n(Fe3+)×100%,称取a g聚合硫酸铁产品溶于足量的盐酸中,溶液均分两等份,向一份中加入足量的铜片,充分反应后铜片减轻4.48g,n(Cu)=
=0.07mol,是铁离子和铜反应,2Fe3++Cu=2Fe2++Cu2+,据此计算铁离子物质的量=0.14mol,原ag产品中含铁离子为0.28mol,向另一份中滴加足量的BaCl2溶液,得到干燥的沉淀46.6g,沉淀为硫酸钡,物质的量n(BaSO4)=
=0.2mol,原ag产品中硫酸根离子物质的量为0.4mol,结合电荷守恒计算氢氧根离子物质的量,n(OH-)=3n(Fe3+)-2n(SO42-)=3×0.14mol-2×0.4mol=0.04mol,计算得到盐基度=
×100%=14.3%,
故答案为:14.3%.
(1)上述分析可知,操作1为过滤操作,故答案为:过滤;
(2)盐基度是指产品中n(OH-)、n(Fe3+) 的比值,即盐基度=n(OH-)/n(Fe3+)×100%,称取a g聚合硫酸铁产品溶于足量的盐酸中,溶液均分两等份,向一份中加入足量的铜片,充分反应后铜片减轻4.48g,n(Cu)=
| 4.48g |
| 64g/mol |
| 46.6g |
| 233g/mol |
| 0.04mol |
| 0.28mol |
故答案为:14.3%.
看了硫酸亚铁晶体(FeSO4•7H...的网友还看了以下:
《个人贷款管理暂行办法》在建立个人贷款管理机制方面向贷款人提出的要求是( )。A.建立有效的个人 2020-05-27 …
英语翻译有关合同(contract),有如下问题需要讨论:1.我们与其他客户已签订的订单及目前正在 2020-07-13 …
诗词中常将“秦皇”与“汉武”并称,秦朝与汉朝对我国封建社会的历史影响深远。(1)秦始皇为了巩固统一 2020-07-28 …
化学的题1,水基型灭火器的工作原理(化学方程式)2,用廉价的碱制取贵重碱的原理(同上)3,“化学的 2020-08-02 …
改一句病句探春管理荣国府之后,在管理体制方面采取了一系列卓有成效的改革,兴利除弊,连王熙凤也自愧不如 2020-11-26 …
下列各句中,没有语病的一句是()A.探春管理荣国府之后在管理体制方面采取了一系列卓有成效的改革,兴利 2020-11-26 …
我们常用的数是十进制数,而计算机中程序处理数据使用的只有数码0与1的二进制数,这二者可以相互换算,如 2020-12-05 …
诗词中常将“秦皇”与“汉武”并称,秦朝与汉朝对我国封建社会的历史影响深远.(1)秦始皇为了巩固统一多 2020-12-29 …
年开始,以城市为重点的全面展开,改革的中心环节是增加,把企业搞活。在管理体制方面,实行政企分开,,扩 2021-01-08 …
英语翻译1,厂内异常处理2,制程异常处理 2021-01-12 …