早教吧作业答案频道 -->化学-->
如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.(1)向小烧杯中先加入50.0mL1.0mol/L
题目详情
如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.
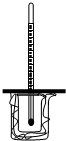
(1)向小烧杯中先加入50.0mL1.0mol/L硫酸,再一次性加入50.0Ml 1.1mol/L 氢氧化钡溶液,重复实验三次,温度计平均升高温度t℃.已知所得溶液密度1g/mL,比热容为4.18kJ/(kg•℃),试写出该反应的热化学方程式___.
(2)若把硫酸改成盐酸,Ba(OH)2改成NaOH,其他条件不变,你估计温度计升高数值为___
A.等于tB.在0.5t~t间C.等于0.5tD.小于0.5t
此反应的离子方程式为___.

(1)向小烧杯中先加入50.0mL1.0mol/L硫酸,再一次性加入50.0Ml 1.1mol/L 氢氧化钡溶液,重复实验三次,温度计平均升高温度t℃.已知所得溶液密度1g/mL,比热容为4.18kJ/(kg•℃),试写出该反应的热化学方程式___.
(2)若把硫酸改成盐酸,Ba(OH)2改成NaOH,其他条件不变,你估计温度计升高数值为___
A.等于tB.在0.5t~t间C.等于0.5tD.小于0.5t
此反应的离子方程式为___.
▼优质解答
答案和解析
(1)依据题意:50.0mL1.0mol/L硫酸中含有硫酸的物质的量为0.05mol,50.0Ml 1.1mol/L 氢氧化钡溶液含有氢氧化钡物质的量为:0.055mol,硫酸少量完全反应生成0.05mol硫酸钡,放出热量为:Q=4.18kJ/(kg•℃)×0.100Kg×t=0.418tKJ,则依据方程式:H2SO4(aq)+Ba(OH)2(aq)=BaSO4↓+2H2O(l),生成1mol硫酸钡放出热量为:8.36KJt,反应的热化学方程式:H2SO4(aq)+Ba(OH)2(aq)=BaSO4↓+2H2O(l)△H=-8.36 tkJ/mol;
故答案为:H2SO4(aq)+Ba(OH)2(aq)=BaSO4↓+2H2O(l)△H=-8.36 tkJ/mol;
(2)盐酸与氢氧化钠反应实质氢离子与氢氧根离子发生酸碱中和,离子方程式:H++OH-=H2O,硫酸与氢氧化钡反应除了发生酸碱中和外,硫酸根离子与钡离子反应生成硫酸钡沉淀,液放出一部分热量,硫酸、氢氧化钡分别换为盐酸和氢氧化钠则生成的水为原来一半,所以反应放出热量应小于原来一半,
温度计升高数值小于0.5t;
故答案为:D;H++OH-=H2O.
故答案为:H2SO4(aq)+Ba(OH)2(aq)=BaSO4↓+2H2O(l)△H=-8.36 tkJ/mol;
(2)盐酸与氢氧化钠反应实质氢离子与氢氧根离子发生酸碱中和,离子方程式:H++OH-=H2O,硫酸与氢氧化钡反应除了发生酸碱中和外,硫酸根离子与钡离子反应生成硫酸钡沉淀,液放出一部分热量,硫酸、氢氧化钡分别换为盐酸和氢氧化钠则生成的水为原来一半,所以反应放出热量应小于原来一半,
温度计升高数值小于0.5t;
故答案为:D;H++OH-=H2O.
看了如图所示,大烧杯中放入一小烧杯...的网友还看了以下:
温度计碎了不小心把温度计打碎了,水银就找到一少部分,剩下的小部分不知道跑哪去了,我用手在地上擦水银 2020-05-14 …
相同容量的热水器,瓦数一样,进水温度一样,请问30度烧到35度、35度烧到40度,40-45,45 2020-05-23 …
烧伤达真皮深层,但皮肤附件残留,形成水泡,水肿明显,判断为: ()A.Ⅰ度烧伤B.浅Ⅱ度烧伤C.深Ⅱ 2020-06-07 …
一道逻辑推理题从某发高度扔下石头会碎而从低于该高度仍都不会碎(不管仍多少次),从高于该高度扔都会碎 2020-06-16 …
纯水的凝固点是0摄氏度,海水的凝固点是-20.5摄氏度,这说明水中如果掺有食盐,其凝固点会降低,小 2020-07-06 …
温度计碎了水银掉到了一兜干枣里这些干枣还能食用吗温度计碎了里面一部分的水银掉到了一塑料袋干枣里面这 2020-07-13 …
有一个1.5升的容器装满碎石后,碎石质量为2.55千克,为测碎石的表观密度,把碎石倒入了一个7.7 2020-07-17 …
小华把0度的碎冰块放在保温杯中,在冰中撒一些食盐,搅拌后用温度计插在碎冰块内测量其温度,发现所测得的 2020-11-16 …
水银温度及碎了怎么办?今天打碎了支温度计,掉进厕所里了,玻璃管捡上来了但是水银珠在厕所里,冲又冲不下 2020-12-19 …
(2007•丰台区一模)桌上有烧杯、大水槽和量筒(如图所示)及足够的水,要求用这些器材粗略测出碎石子 2021-02-04 …