“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO 2 的含量和有效地开发利用CO 2 正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H 2 O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H 2 O(g)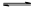 CO 2 (g)+H 2 (g),得到如下三组数据:
CO 2 (g)+H 2 (g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H 2 O | H 2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H 2 O、CO 2 、H 2 均为1mol,则此时V 正 V 逆 (填“<” ,“>” ,“=”)。
(2)已知在常温常压下:
①2CH 3 OH(l) + 3O 2 (g) = 2CO 2 (g) + 4H 2 O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O 2 (g) = 2CO 2 (g) ΔH=-566.0 kJ/mol
③H 2 O(g) = H 2 O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC 2 O 4 )溶液显酸性。常温下,向10 mL 0.01 mol·L -1 H 2 C 2 O 4 溶液中滴加10mL 0.01mol·L -1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(4)CO 2 在自然界循环时可与CaCO 3 反应,CaCO 3 是一种难溶物质,其Ksp=2.8×10 -9 。CaCl 2 溶液与Na 2 CO 3 溶液混合可形成CaCO 3 沉淀,现将等体积的CaCl 2 溶液与Na 2 CO 3 溶液混合,若Na 2 CO 3 溶液的浓度为2×10 -4 mol/L ,则生成沉淀所需CaCl 2 溶液的最小浓度为 _______________mol/L。
(5)以二甲醚(CH 3 OCH 3 )、空气、H 2 SO 4 为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式: 。
已知298K时,2SO2(g)+O2(g)2SO3(g);ΔH=-197kJ·mol-1。在相同的 2020-05-01 …
已知298K,101kPa时,2SO2(g)+O2(g)2SO3(g);△H=-197kJ·mol 2020-05-01 …
判断化学反应平衡A(g)+3B(g)=(可逆)2C(g)密闭容器中,以下是否正确:1.生成和分解C 2020-05-16 …
平衡热度断热容器中同时放入50摄氏度的水200g和-15摄氏度冰100g.水的比热为4.2J/gk 2020-06-12 …
在一定温度下,某容积不便的密闭容器中发生可逆反应N2(g)+3H2(g)==2NH3(g)(正反应 2020-06-17 …
已知298K,101kPa时,2SO2(g)+O2(g)⇌2SO3(g)△H=-197kJ•m 2020-07-18 …
在一个固定容积的密闭容器,向容器中冲入2molA和1molB发生反映2A(G)+B(G)可逆符号3C 2020-11-01 …
化学平衡移动题求高手帮助甲、乙两个容器都发生2SO2(g)+O2(g)=2so3(g)两容器的温度和 2021-01-22 …
化学平衡到底是看浓度还是压强,浓度改变压强也改变.变了2个怎么判断?如题在一定温度下,一容积固定的密 2021-01-22 …
某同学在“测液体的密度”的实验中,测得的数据如表.⊙⊙⊙⊙液体和容器的总质量(g)⊙22⊙38⊙m⊙ 2021-02-20 …