早教吧作业答案频道 -->化学-->
立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得.用含锌废料制取立德粉的实验流程如图:(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有
题目详情
立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得.用含锌废料制取立德粉的实验流程如图:
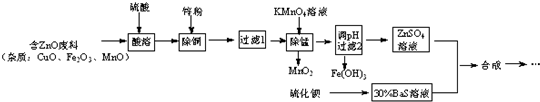
(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有___.
(2)加入锌粉被还原的离子有___.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是___.
(4)若所得ZnSO4酸性较强,可采取的简单措施是___.
(5)两种溶液合成立德粉,还需要经过陈化、___、___、___、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是___.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
实验中可选用的试剂:30% H2O2、3.0mol•L-1 H2SO4、1.0mol•L-1 NaOH.
实验步骤依次为:
①___;
②___;
③___;
④过滤得滤液.

(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有___.
(2)加入锌粉被还原的离子有___.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是___.
(4)若所得ZnSO4酸性较强,可采取的简单措施是___.
(5)两种溶液合成立德粉,还需要经过陈化、___、___、___、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是___.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验步骤依次为:
①___;
②___;
③___;
④过滤得滤液.
▼优质解答
答案和解析
(1)配制30%BaS溶液需要及时称量固体质量溶解,搅拌等步骤,配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有称量需要的托盘天平,
故答案为:托盘天平;
(2)含锌废料中加入硫酸溶解,加入锌粉还原溶解生成的铁离子和铜离子,加入锌粉被还原的离子有Fe3+、Cu2+,
故答案为:Fe3+、Cu2+;
(3)在弱酸性条件下,KMnO4除Mn2+时发生氧化还原反应生成二氧化锰,结合电荷守恒,原子守恒配平书写离子方程式为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H +,
故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H +;
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解,
故答案为:加少量的锌粉,搅拌直到溶解;
(5)立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得,生成的产物需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品,
故答案为:过滤、洗涤、干燥.
(6)立德粉成品白度不够,可能是含有有色金属离子,流程分析可能混入的杂质离子为铜离子、锰离子、铁离子等有色离子,在除杂过程中未除净,
故答案为:Cu2+、Mn2+及Fe3+没有除尽
(7)从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,需要除去杂质离子,金属单质需要溶于酸后调节溶液PH除去,因为制备的是硫酸锌,所以加入酸溶应为硫酸,溶解后过滤,得到滤液主要是硫酸锌和硫酸亚铁,依据沉淀完全需要的PH,应加入氧化剂过氧化氢氧化亚铁离子为铁离子,然后调节 溶液PH全部沉淀铁离子,锌离子不沉淀,达到除杂目的,实验步骤为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮,
②加入适量30% H2O2,使其充分反应,
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,
故答案为:用稍过量3.0 mol•L-1 H2SO4溶解废锌皮,加入适量30% H2O2,使其充分反应,1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
故答案为:托盘天平;
(2)含锌废料中加入硫酸溶解,加入锌粉还原溶解生成的铁离子和铜离子,加入锌粉被还原的离子有Fe3+、Cu2+,
故答案为:Fe3+、Cu2+;
(3)在弱酸性条件下,KMnO4除Mn2+时发生氧化还原反应生成二氧化锰,结合电荷守恒,原子守恒配平书写离子方程式为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H +,
故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H +;
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解,
故答案为:加少量的锌粉,搅拌直到溶解;
(5)立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得,生成的产物需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品,
故答案为:过滤、洗涤、干燥.
(6)立德粉成品白度不够,可能是含有有色金属离子,流程分析可能混入的杂质离子为铜离子、锰离子、铁离子等有色离子,在除杂过程中未除净,
故答案为:Cu2+、Mn2+及Fe3+没有除尽
(7)从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,需要除去杂质离子,金属单质需要溶于酸后调节溶液PH除去,因为制备的是硫酸锌,所以加入酸溶应为硫酸,溶解后过滤,得到滤液主要是硫酸锌和硫酸亚铁,依据沉淀完全需要的PH,应加入氧化剂过氧化氢氧化亚铁离子为铁离子,然后调节 溶液PH全部沉淀铁离子,锌离子不沉淀,达到除杂目的,实验步骤为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮,
②加入适量30% H2O2,使其充分反应,
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,
故答案为:用稍过量3.0 mol•L-1 H2SO4溶解废锌皮,加入适量30% H2O2,使其充分反应,1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
看了立德粉是一种白色颜料,可通过反...的网友还看了以下:
已知在水溶液中I2+I-I-3。锌粉与碘单质的混合物,加入少量水作催化剂,便可发生化合反应,生成碘 2020-04-06 …
铜锌原电池(铜插硫酸铜,锌插硫酸锌,两溶液盐桥联接)当锌溶解,溶液锌离子数增加 问撤除盐桥和锌片后 2020-05-15 …
纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2 2020-06-21 …
中考物质的提纯.氯化铵和氯化锌的混合溶液,两种溶质质量相近.加热浓缩,降温结晶后析出的是哪种?氯化 2020-06-27 …
硫酸锌溶液通入氨气,硫酸锌水溶液,通入氨气反应的产物.是氢氧化锌,和硫酸铵吗? 2020-07-22 …
以反应Zn+H2SO4═ZnSO4+H2↑为例,研究化学反应中的能量变化情况.(1)将纯锌片直接插入 2020-11-01 …
锌溶于氢氧化钠加水中最大能溶到多少克每升啊?我将锌溶于加水的氢氧化钠中,昨天氢氧化钠是350g/L, 2020-11-01 …
锌和铝都是活泼金属,化学性质相似,其氢氧化物既能溶于强酸,也能溶于强碱,都是两性氢氧化物.但是氢氧化 2020-11-02 …
化学原电池的双液原电池,锌为什么会失电子?负极锌,正极铜.锌的溶液是硫酸锌铜的溶液是硫酸铜盐桥是氯化 2020-11-21 …
取36.8g稀硫酸倒入烧杯中,向烧杯中投入一块足量的锌片,待硫酸作用完后,锌片质量减轻6.5g再将烧 2020-11-27 …