早教吧作业答案频道 -->化学-->
苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯.它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等.
题目详情
苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯. 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等.其制备方法为:
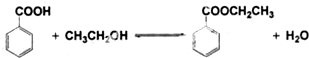
已知:
已知:苯甲酸在100℃会迅速升华.
实验步骤如下:
①在圆底烧瓶中加入4.0g苯甲酸,10mL 95%的乙醇(过量),8mL环己烷以及3mL浓硫酸,混合均匀并加入沸石,按图所示装好仪器,控制温度在65~70℃加热回流2h.利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
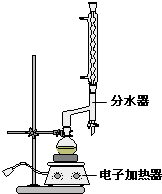
②反应一段时间,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性.用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分.
④检验合格,测得产品体积为2.3mL.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是___(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①加入沸石的作用是___.如果加热一段时间后发现忘记加沸石,应该采取的正确操作是:___
(3)步骤①中使用分水器不断分离除去水的目的是___
(4)步骤③加入Na2CO3加入不足,在之后蒸馏时蒸馏烧瓶中可见到白烟生成,产生该现象的原因___;
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须___
(6)计算本实验的产率为___.
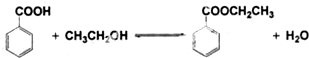
已知:
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在圆底烧瓶中加入4.0g苯甲酸,10mL 95%的乙醇(过量),8mL环己烷以及3mL浓硫酸,混合均匀并加入沸石,按图所示装好仪器,控制温度在65~70℃加热回流2h.利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.

②反应一段时间,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性.用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分.
④检验合格,测得产品体积为2.3mL.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是___(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①加入沸石的作用是___.如果加热一段时间后发现忘记加沸石,应该采取的正确操作是:___
(3)步骤①中使用分水器不断分离除去水的目的是___
(4)步骤③加入Na2CO3加入不足,在之后蒸馏时蒸馏烧瓶中可见到白烟生成,产生该现象的原因___;
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须___
(6)计算本实验的产率为___.
▼优质解答
答案和解析
(1)烧瓶所能盛放溶液的体积不超过烧瓶体积的
,现在加入圆底烧瓶中液体的体积大约为21mL,所以选取烧瓶的体积应该为50mL,
故答案为:B;
(2)给混合液体加热时容易发生暴沸现象,步骤①加入沸石的作用是防止爆沸;如果加热一段时间后发现忘记加沸石,则应等烧瓶冷却后再补加,以免发生危险,
故答案为:防止爆沸;冷却后补加;
(3)反应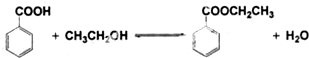 为可逆反应,生成物中有水生成,步骤①中使用分水器不断分离除去水,可以使生成物的浓度减小,化学平衡向着正向移动,从而增大了产率,
为可逆反应,生成物中有水生成,步骤①中使用分水器不断分离除去水,可以使生成物的浓度减小,化学平衡向着正向移动,从而增大了产率,
故答案为:使平衡不断地向正向移动;
(4)加入碳酸钠的目的是除去苯甲酸乙酯中的苯甲酸,若加入的碳酸钠不足,则产品中存在苯甲酸,而苯甲酸在100℃会迅速升华,则蒸馏时会出现白烟现象,
故答案为:在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华;
(5)分液漏斗有旋塞,所以使用分液漏斗前必须检查是否漏水,
故答案为:检查是否漏水;
(6)根据反应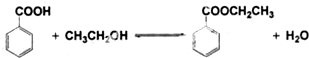 可知,理论上4.0g苯甲酸与足量乙醇反应生成苯甲酸乙酯的质量为:
可知,理论上4.0g苯甲酸与足量乙醇反应生成苯甲酸乙酯的质量为:
×150g/mol=4.92g,实际上获得苯甲酸乙酯的质量是:2.3mL×1.05g/mL=2.415g,
所以本实验的产率为:
×100%=49.1%,
故答案为:49.1%.
| 2 |
| 3 |
故答案为:B;
(2)给混合液体加热时容易发生暴沸现象,步骤①加入沸石的作用是防止爆沸;如果加热一段时间后发现忘记加沸石,则应等烧瓶冷却后再补加,以免发生危险,
故答案为:防止爆沸;冷却后补加;
(3)反应
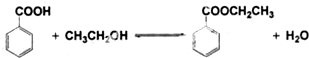 为可逆反应,生成物中有水生成,步骤①中使用分水器不断分离除去水,可以使生成物的浓度减小,化学平衡向着正向移动,从而增大了产率,
为可逆反应,生成物中有水生成,步骤①中使用分水器不断分离除去水,可以使生成物的浓度减小,化学平衡向着正向移动,从而增大了产率,故答案为:使平衡不断地向正向移动;
(4)加入碳酸钠的目的是除去苯甲酸乙酯中的苯甲酸,若加入的碳酸钠不足,则产品中存在苯甲酸,而苯甲酸在100℃会迅速升华,则蒸馏时会出现白烟现象,
故答案为:在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华;
(5)分液漏斗有旋塞,所以使用分液漏斗前必须检查是否漏水,
故答案为:检查是否漏水;
(6)根据反应
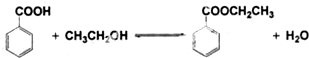 可知,理论上4.0g苯甲酸与足量乙醇反应生成苯甲酸乙酯的质量为:
可知,理论上4.0g苯甲酸与足量乙醇反应生成苯甲酸乙酯的质量为:| 4.0g |
| 122g/mol |
所以本实验的产率为:
| 2.415g |
| 4.92g |
故答案为:49.1%.
看了苯甲酸乙酯(C9H10O2)别...的网友还看了以下:
食醋中乙酸的化学式为CH3COOH,下列关于乙酸的说法正确的是()A.乙酸中含有8个原子B.乙酸分 2020-04-11 …
食醋中乙酸的化学式为CH3COOH,下列关于乙酸的说法正确的是[]A.乙酸中含有8个原子B.乙酸分 2020-04-11 …
已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜.( 2020-05-13 …
乙酸乙酯和石蕊在实验室制得1ml乙酸乙酯后,沿器壁加入0.5ml紫色石蕊溶液,这时石蕊溶液讲存在于 2020-05-23 …
关于乙酸乙脂的问题乙酸乙脂的结构简式:CH3C=OOC2H5这个里面并没有羧基"C=OOH"啊.. 2020-06-06 …
草毒、香蕉等水果具有芳香气味,是因为其中含有乙酸乙酯(化学式为C4H8O2)等物质,下列关于乙酸乙 2020-07-09 …
已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜.( 2020-07-19 …
乙酸乙酯(CH3COOCH2CH3)存在于许多酒以及菠萝、香蕉等果品中.白酒中主要成分乙醇与少量存在 2020-10-29 …
下列关于乙酸的说法中,正确的是()①乙酸易溶于水和乙醇,其水溶液能导电②无水乙酸又称为冰醋酸,它是纯 2020-11-29 …
已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜.(一 2021-01-26 …