早教吧作业答案频道 -->化学-->
如图所示为工业生产中三氯氧磷的制取流程及产品部分性质:已知:①三氯化磷为无色澄清液体,极易水解生成亚磷酸(H3PO3,二元弱酸),同时放出大量热;②Knp[Ca3(PO4)2]=2×10-29;③
题目详情
如图所示为工业生产中三氯氧磷的制取流程及产品部分性质: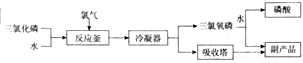
已知:①三氯化磷为无色澄清液体,极易水解生成亚磷酸(H3PO3,二元弱酸),同时放出大量热;
②Knp[Ca3(PO4)2]=2×10-29;③
=0.585.结合流程及相关信息,回答下列问题;
(1)写出三氯化磷水解的化学方程式___,写出亚磷酸与足量氢氧化钠溶液反应的化学方程式___.
(2)三氯氧磷分子中磷元素化合价为___,0.1molPOCl3最多可消耗4mol•L-1NaOH溶液___mL.
(3)流程中反应釜中生成的氧化产物与还原产物的物质的量之比为___.
(4)工业生产中会产生含磷废水(H3PO4、H3PO3),处理时先加入适量漂白粉,再加入生石灰调节pH,若处理后的废水中c(PO43-)<10-5mol/L可认为PO43-沉淀完全,则此时c(Ca2+)至少为___mol•L-1.
(5)某同学想测定三氯氧磷产品纯度,设计方案为:取一定量的产品在碱性条件下水解,然后加入足量AgNO3溶液,过滤、洗涤干燥,称量生成沉淀的质量即为氯化银的质量,由此计算产品纯度,该方案有明显错误或不足,请指出:___.
(6)磷酸燃料电池是当前商业化发展得最快的一种燃料电池,使用磷酸为电解质,工作温度150~200℃,比质子交换膜燃料电池和碱性燃料电池工作温度高,如图是甲烷、氧气,磷酸燃料电池工作示意图: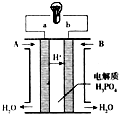
该电池a极为电池___极,电极反应为___,该极电极反应要比质子交换膜燃料电池的速度快,可能原因是___.

已知:①三氯化磷为无色澄清液体,极易水解生成亚磷酸(H3PO3,二元弱酸),同时放出大量热;
②Knp[Ca3(PO4)2]=2×10-29;③
| -3 | 0.2 |
(1)写出三氯化磷水解的化学方程式___,写出亚磷酸与足量氢氧化钠溶液反应的化学方程式___.
(2)三氯氧磷分子中磷元素化合价为___,0.1molPOCl3最多可消耗4mol•L-1NaOH溶液___mL.
(3)流程中反应釜中生成的氧化产物与还原产物的物质的量之比为___.
(4)工业生产中会产生含磷废水(H3PO4、H3PO3),处理时先加入适量漂白粉,再加入生石灰调节pH,若处理后的废水中c(PO43-)<10-5mol/L可认为PO43-沉淀完全,则此时c(Ca2+)至少为___mol•L-1.
(5)某同学想测定三氯氧磷产品纯度,设计方案为:取一定量的产品在碱性条件下水解,然后加入足量AgNO3溶液,过滤、洗涤干燥,称量生成沉淀的质量即为氯化银的质量,由此计算产品纯度,该方案有明显错误或不足,请指出:___.
(6)磷酸燃料电池是当前商业化发展得最快的一种燃料电池,使用磷酸为电解质,工作温度150~200℃,比质子交换膜燃料电池和碱性燃料电池工作温度高,如图是甲烷、氧气,磷酸燃料电池工作示意图:

该电池a极为电池___极,电极反应为___,该极电极反应要比质子交换膜燃料电池的速度快,可能原因是___.
▼优质解答
答案和解析
(1)三氯化磷中P为+3价,可水解生成亚磷酸和盐酸,方程式为PCl3+3H2O=H3PO3+3HCl,亚磷酸为二元酸,发生H3PO3+2NaOH=Na2HPO3+2H2O,
故答案为:PCl3+3H2O=H3PO3+3HCl;
(2)POCl3中P元素化合价为+5价,可水解生成磷酸和盐酸,则0.1molPOCl3可水解生成0.1mol磷酸、0.3mol盐酸,最多可消耗4mol•L-1NaOH溶液0.6mol,体积为
=0.15L=150mL,故答案为:+5;150;
(3)流程中发生PCl3+Cl2+H2O=POCl3+2HCl,氧化剂为Cl2,还原产物为HCl,还原剂为PCl3,POCl3为氧化产物,则氧化产物与还原产物的物质的量之比为1:2,
故答案为:1:2;
(4)Ksp[Ca3(PO4)2]=c2(PO43-)×c3(Ca2+)=2×10-29,若处理后的废水中c(PO43-)<10-5mol/L,
则c(Ca2+)=
mol/L=5.85×10-7mol/L,
故答案为:5.85×10-7mol/L;
(5)产品在碱性条件下水解,溶液中存在氢氧根离子以及磷酸根离子,则加入硝酸银,可生成氯化银、AgOH以及磷酸银等,
故答案为:沉淀不仅含有氯化银,还含有氢氧化银、磷酸银;
(6)由氢离子移动方向可知a为负极,b为正极,正极发生氧化反应,电极方程式为CH4-8e-+2H2O=8H++CO2,由于工作温度较高,则反应速率大,
故答案为:负;CH4-8e-+2H2O=8H++CO2;该电池工作温度高.
故答案为:PCl3+3H2O=H3PO3+3HCl;
(2)POCl3中P元素化合价为+5价,可水解生成磷酸和盐酸,则0.1molPOCl3可水解生成0.1mol磷酸、0.3mol盐酸,最多可消耗4mol•L-1NaOH溶液0.6mol,体积为
| 0.6mol |
| 4mol/L |
(3)流程中发生PCl3+Cl2+H2O=POCl3+2HCl,氧化剂为Cl2,还原产物为HCl,还原剂为PCl3,POCl3为氧化产物,则氧化产物与还原产物的物质的量之比为1:2,
故答案为:1:2;
(4)Ksp[Ca3(PO4)2]=c2(PO43-)×c3(Ca2+)=2×10-29,若处理后的废水中c(PO43-)<10-5mol/L,
则c(Ca2+)=
| 3 |
| ||
故答案为:5.85×10-7mol/L;
(5)产品在碱性条件下水解,溶液中存在氢氧根离子以及磷酸根离子,则加入硝酸银,可生成氯化银、AgOH以及磷酸银等,
故答案为:沉淀不仅含有氯化银,还含有氢氧化银、磷酸银;
(6)由氢离子移动方向可知a为负极,b为正极,正极发生氧化反应,电极方程式为CH4-8e-+2H2O=8H++CO2,由于工作温度较高,则反应速率大,
故答案为:负;CH4-8e-+2H2O=8H++CO2;该电池工作温度高.
看了如图所示为工业生产中三氯氧磷的...的网友还看了以下:
实验室中可用如图1所示装置制取氯酸钾(KClO3),、次氯酸钠和探究氯水的性质.图1中:①为氯气发 2020-05-16 …
物质溶于水时与水反应,所形成的溶液溶质是什么?CL2溶与水时有如下反应CL2+H20=HCL+HC 2020-06-22 …
2.0摩尔三氯化磷和1.0摩氯气充入体积不变的固定容器中生成五氯化磷.达平衡时.五氯化磷为0.4摩 2020-06-28 …
某学习小组同学以二氧化锰和浓盐酸为原料,连接A→B→C制取氯水。(1)装置A中发生反应的离子方程式 2020-07-20 …
新制氯水呈浅黄绿色,新制氯水中溶质为氯气(Cl2),而氯气在水中溶解度不大,故新制氯水呈浅黄绿色. 2020-07-21 …
凡是由“碳氢氯氮氧磷硫”组成的都是农药.这句话对吗?如:“毒死蜱”(C9H11Cl3NO3PS)、氯 2020-10-31 …
氯气(Cl2)是黄绿色气体,水溶液叫氯水.把品红试纸(染有品红的试纸)伸入氯水中,品红褪色.提出问题 2020-11-24 …
在新制的氯水参加的反应中,有如下几种情况:(1)向FeCl2和KSCN的混合溶液中加入氯水,现象是, 2020-12-12 …
化学平衡问题!急!五氯化磷可逆生成三氯化磷和氯气(均为气体).在平衡后再加入一定量的五氯化磷,则转化 2020-12-15 …
凡是由“碳氢氯氮氧磷硫”组成的都是农药.这句话对吗?如:“毒死蜱”(C9H11Cl3NO3PS)、氯 2020-12-22 …