早教吧作业答案频道 -->化学-->
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:(1)Cu位于元素周期表族.Cu2+的核外电子排布式为.(2)CuS
题目详情
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
(1)Cu位于元素周期表___ 族.Cu2+的核外电子排布式为___.
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___;CuSO4粉末常用来检验一些有机物中的微量水分,其原因是___.
(3)SO42-的立体构型是___,其中S原子的杂化轨道类型是___.
(4)Cu2O的熔点比Cu2S的___(填“高”或“低”),请解释原因___.
(5)往硫酸铜溶液中加入过量氨水,可生成2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___.
(6)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为___;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为___;该晶体中,原子之间的作用力是___.
(7)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为___.
(1)Cu位于元素周期表___ 族.Cu2+的核外电子排布式为___.
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___;CuSO4粉末常用来检验一些有机物中的微量水分,其原因是___.
(3)SO42-的立体构型是___,其中S原子的杂化轨道类型是___.
(4)Cu2O的熔点比Cu2S的___(填“高”或“低”),请解释原因___.
(5)往硫酸铜溶液中加入过量氨水,可生成2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___.
(6)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为___;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为___;该晶体中,原子之间的作用力是___.
(7)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为___.
▼优质解答
答案和解析
(1)铜是29号元素,位于周期表中第四周期,第ⅠB族,根据原子核外电子排布规律可写出Cu2+的核外电子排布式为1s22s22p63s23p63d9,
故答案为:ⅠB;1s22s22p63s23p63d9;
(2)加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O,白色无水硫酸铜可与水结合生成蓝色的CuSO4•5H2O,显示水合铜离子特征蓝色;
故答案为:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O;白色无水硫酸铜可与水结合生成蓝色的CuSO4•5H2O;
(3)SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
故答案为:正四面体;sp3;
(4)氧离子的半径小于硫离子,半径越小,晶格能越大,物质的熔沸点就越高,所以Cu2O的熔点比Cu2S的高;
故答案为:高;半径越小,晶格能越大,物质的熔沸点就越高;
(5)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
故答案为:F的电负性大于N,NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键;
(6)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则最外层电子排布式为6s1,在晶胞中Cu原子处于面心,N(Cu)=6×
=3,Au原子处于顶点位置,N(Au)=8×
=1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键;
故答案为:6s1;3:1;金属键;
(7)CaF2的结构如图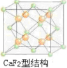 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
故答案为:Cu3AuH8.
故答案为:ⅠB;1s22s22p63s23p63d9;
(2)加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2 H2SO4(浓)
| ||
故答案为:Cu+2 H2SO4(浓)
| ||
(3)SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
故答案为:正四面体;sp3;
(4)氧离子的半径小于硫离子,半径越小,晶格能越大,物质的熔沸点就越高,所以Cu2O的熔点比Cu2S的高;
故答案为:高;半径越小,晶格能越大,物质的熔沸点就越高;
(5)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
故答案为:F的电负性大于N,NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键;
(6)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则最外层电子排布式为6s1,在晶胞中Cu原子处于面心,N(Cu)=6×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:6s1;3:1;金属键;
(7)CaF2的结构如图
 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;故答案为:Cu3AuH8.
看了铜是重要金属,Cu的化合物在科...的网友还看了以下:
计算曲面积分∫∫S(2x+z)dydz+zdxdy,其中S为有向曲面z=x2+y2(0≤z≤1), 2020-06-14 …
图1是“研究匀变速直线运动”实验中获得的一条纸带,O、A、B、C、D和E为纸带上六个计数点.图2是 2020-06-25 …
如图甲是“研究匀变速直线运动”实验中获得的一条纸带,O、A、B、C、D和E为纸带上六个计数点,加速 2020-06-25 …
图甲是“研究匀变速直线运动”实验中获得的一条纸带,O、A、B、C、D和E为纸带上六个计数点,加速度 2020-06-25 …
(1)图是“研究匀速直线运动”实验中获得的一条纸带,O、A、B、C、D和E为纸带上六个计数点。加速 2020-06-25 …
如图是“研究匀变速直线运动”实验中获得的一条纸带,O、A、B、C、D和E为纸带上六个计数点.(1) 2020-07-04 …
设S为实数集R的非空子集,若对任意x,y∈S,都有x+y,x-y,xy∈S,则称S为封闭集,下列命 2020-07-29 …
已知元素为实数的集合S满足下列条件:①0∉S,1∉S;②若a∈S,则11-a∈S.(Ⅰ)若{2,-2 2020-12-07 …
人们发现汽车在行驶中所受到的空气阻力F,与汽车迎风面积S和汽车行驶速度有关.研究人员通过实验得到有关 2020-12-10 …
运用化学原理知识研究化学对于人类的生产生活、科研意义重大.(1)工业上以黄铜矿(主要成分:CuFeS 2020-12-22 …