早教吧作业答案频道 -->化学-->
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.(1)Mg2Ni是一种储氢合金,已知:Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1Mg2Ni(s)+2H2(g
题目详情
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
则△H3=___kJ•mol-1.
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2•6H2O转化为MgCl2•NH4Cl•nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为___;电解熔融氯化镁,阴极的电极反应式为___
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2+2A1+3H2↑每生成27gAl转移电子的物质的量为___
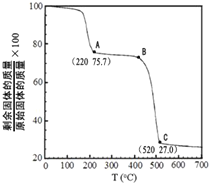
(4)工业上用MgC2O4•2H2O热分解制超细MgO,其热分解曲线如图.图中隔绝空气条件下B→C发生反应的化学方程式为___.

(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
则△H3=___kJ•mol-1.
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2•6H2O转化为MgCl2•NH4Cl•nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为___;电解熔融氯化镁,阴极的电极反应式为___
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2+2A1+3H2↑每生成27gAl转移电子的物质的量为___
(4)工业上用MgC2O4•2H2O热分解制超细MgO,其热分解曲线如图.图中隔绝空气条件下B→C发生反应的化学方程式为___.
▼优质解答
答案和解析
(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3=-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6kJ/mol,则△H3=+84.6kJ/mol,
故答案为:+84.6;
(2)MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式:MgCl2•NH4Cl•nNH3
MgCl2+(n+1)NH3↑+HCl↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;
故答案为:MgCl2•NH4Cl•nNH3
MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol,
故答案为:3mol;
(4)工业上用MgC2O4•2H2O热分解制超细MgO,当最后固体完全为MgO时,剩余固体质量占原先固体质量的百分比为:
×100%=27%,所以C点剩余的固体为MgO,MgC2O4•2H2O加热后先失去结晶水,完全失去结晶水后生成MgC2O4时剩余固体质量占原先固体质量的百分比:1-
×100%≈75.7%,说明A点恰好失去结晶水,则B点剩余固体为氧化镁和草酸镁的混合物,草酸镁中C的化合价为+3价,根据氧化还原反应特点可知,草酸镁分解生成一氧化碳和二氧化碳气体,反应的化学方程式为:MgC2O4
MgO+CO↑+CO2↑,
故答案为:MgC2O4
MgO+CO↑+CO2↑.
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3=-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6kJ/mol,则△H3=+84.6kJ/mol,
故答案为:+84.6;
(2)MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式:MgCl2•NH4Cl•nNH3
| ||
故答案为:MgCl2•NH4Cl•nNH3
| ||
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol,
故答案为:3mol;
(4)工业上用MgC2O4•2H2O热分解制超细MgO,当最后固体完全为MgO时,剩余固体质量占原先固体质量的百分比为:
| 40 |
| 148 |
| 36 |
| 148 |
| ||
故答案为:MgC2O4
| ||
看了镁是海水中含量较多的金属,镁、...的网友还看了以下:
已知:2Zn(s)+O2(g)=2ZnO(s)△H=-701.0kJ/mol2Hg(l)+O2(g 2020-04-07 …
拉普拉斯变换:l{tsin5t}=?已知:l{t}=1/s^2,l{sinwt}=w^2/s拉普拉 2020-06-12 …
Dy3+的4F9/2→6H13/2跃迁,其ΔJ=2,属电偶极跃迁,.Δl=0,Δs=0,ΔL=0, 2020-06-12 …
有一段带塑料绝缘皮的铜导线,其质量为m,长度为L,已知其绝缘皮的密度为ρ塑,截面积为S塑,铜的密度 2020-06-21 …
把下面的式子的两边弄成相等的1.FeCl3(aq)+KOH(aq)-->Fe(OH)3(s)+KC 2020-07-09 …
想在matlab里面实现,已知S和R的关系,见'补充'.L已知,S自变量,R因变量,想根据S的值计 2020-08-01 …
一个S开头代表薪水津贴的单词(不是salary),其中包含S/P/L/E,托业词汇中的,和subsi 2020-11-15 …
编译原理文法设文法G(S):S→(L)|a+S|aL→L,S|S求(1)给出G[S]等价的文法G‘[ 2020-11-23 …
设非空集合S={x|m≤x≤l}满足:当x∈S时,有x²∈S.若m=1,则S={1}解析:当m=1时 2020-12-07 …
已知等腰三角形的周长是2l,问它的腰多长时其面积最大这个是高二文科选修的导数.我设腰为x.高就为根号 2021-02-05 …