早教吧作业答案频道 -->化学-->
COCl2的分解反应为COCl2(g)⇌Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):(1)计算反应在第
题目详情
COCl2的分解反应为COCl2(g)⇌Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):
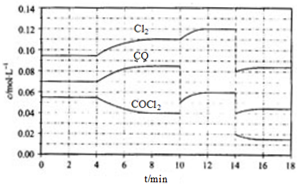
(1)计算反应在第8min时的平衡常数K=___(保留三位小数);
(2)比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)___ T(8)(填“<”、“>”或“=”);
(3)若反应在体积为20L的密闭容器中进行,则4min~10min外界向反应体系提供的能量至少为___.
(4)若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=___mol/L(保留三位小数)
(5)比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6)___ v(15-16)(填“<”、“>”或“=”),原因是___.

(1)计算反应在第8min时的平衡常数K=___(保留三位小数);
(2)比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)___ T(8)(填“<”、“>”或“=”);
(3)若反应在体积为20L的密闭容器中进行,则4min~10min外界向反应体系提供的能量至少为___.
(4)若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=___mol/L(保留三位小数)
(5)比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6)___ v(15-16)(填“<”、“>”或“=”),原因是___.
▼优质解答
答案和解析
(1)由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
=
=0.234mol/L,故答案为:0.234mol/L;
(2)由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),故答案为:<;
(3)4min~10min内COCl2的浓度减少量为(0.055-0.04)mol/L=0.015mol/L,转化COCl2的物质的量为0.015mol/L×20L=0.3mol,吸收的热量为0.3mol×108kJ•mol-1=32.4kJ,即外界至少需要提供23.4kJ能力,故答案为:32.4kJ;
(4)由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:
=0.234mol/L,解得c(COCl2)=0.031mol/L,
故答案为:0.031;
(5)10min瞬间,CO的浓度减小,二氧化碳浓度不变,而后平衡正向移动,不能是改变温度,应是移走CO,14min到达平衡,在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
故答案为:>;在相同温度时,该反应的反应物浓度越高,反应速率越大.
| c(CO)×c(Cl2) |
| c(COCl2) |
| 0.085×0.11 |
| 0.04 |
(2)由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),故答案为:<;
(3)4min~10min内COCl2的浓度减少量为(0.055-0.04)mol/L=0.015mol/L,转化COCl2的物质的量为0.015mol/L×20L=0.3mol,吸收的热量为0.3mol×108kJ•mol-1=32.4kJ,即外界至少需要提供23.4kJ能力,故答案为:32.4kJ;
(4)由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:
| 0.06×0.12 |
| c(COCl2) |
故答案为:0.031;
(5)10min瞬间,CO的浓度减小,二氧化碳浓度不变,而后平衡正向移动,不能是改变温度,应是移走CO,14min到达平衡,在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
故答案为:>;在相同温度时,该反应的反应物浓度越高,反应速率越大.
看了COCl2的分解反应为COCl...的网友还看了以下:
17个科学家,6人一组,7个生物学的,4个物理学,6个化学的,求有多少种组合?2.求2个物理,2个 2020-05-14 …
CaCO3是单质还是化合物?在线等!急~!1、CaCO3是单质还是化合物?2、CO2是单质还是化合 2020-05-16 …
(1/2)重200牛的物体放在水平地面上,物体与地面间的最大静摩擦力为物重的0.2倍,一个人用大小 2020-05-16 …
当有大量数据时,Access如何让两个表之间用ID(自动编号)字段相关联.A表B表C表ID类别ID 2020-05-17 …
H+1,O-2,C+2,S+6,Ca+2(+1-2+2+6+2都标在上面)在这5种元素中选择适当元 2020-06-04 …
(1)弹簧测力计的使用:①看清()和();②使用前要();③所测力的方向与()的方向一致(2)9. 2020-06-05 …
如图所示,有1、2、3三个质量均为m=1kg的物体,物体2与物体3通过不可伸长轻绳连接,跨过光滑的 2020-06-11 …
1.辩活用:①“丈夫之冠也,父命也”的冠;②“君人者隆礼尊贤而王”的贤;③“思物而物之”的物2.明 2020-06-29 …
用弹簧秤称物体,称2千克的物体,弹簧长12.5厘米,称6千克的物体,弹簧长13.5厘米,当称5千克 2020-06-30 …
1、将下列植物与所类群用直线连接起来(1)墙藓A藻类植物(2)紫菜B苔藓植物(3)侧柏C蕨类植物( 2020-07-03 …