早教吧作业答案频道 -->化学-->
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采
题目详情
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___.
向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快.产生气体速率迅速加快的原因是:___.
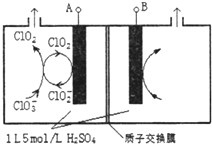
(2)电解法是目前研究最为热门的生产ClO2的方法之一.下图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验.
①电源负极为___极(填A或B):
②写出阴极室发生反应依次为:___、___;
(3)已知:
2SO2(g)+O2 (g)⇌2SO3 (g)△H=-196.6kJ•mol-1
2NO(g)+O2 (g)⇌2NO2 (g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2 (g)⇌SO3 (g)+NO(g)的△H=___kJ•mol-1
一定条件下,将体积比为1:2的NO2(g)、SO2 (g)置于密闭容器中发生上述反应,测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=___.

(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___.
向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快.产生气体速率迅速加快的原因是:___.
(2)电解法是目前研究最为热门的生产ClO2的方法之一.下图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验.
①电源负极为___极(填A或B):
②写出阴极室发生反应依次为:___、___;
(3)已知:
2SO2(g)+O2 (g)⇌2SO3 (g)△H=-196.6kJ•mol-1
2NO(g)+O2 (g)⇌2NO2 (g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2 (g)⇌SO3 (g)+NO(g)的△H=___kJ•mol-1
一定条件下,将体积比为1:2的NO2(g)、SO2 (g)置于密闭容器中发生上述反应,测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=___.
▼优质解答
答案和解析
(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,故化合价由+3价升高到+4价,故部分氯离子降低为-1价,离子反应方程式为:5ClO2-+4H+=4ClO2↑+Cl-,反应开始时,溶液中氯离子浓度很小,随着反应的进行,...
看了研究含Cl、N、S等元素的化合...的网友还看了以下:
日常生活中我们经常用到一些消毒剂,下列有关说法正确的是()A.过氧化氢有“绿色氧化剂”之称,故过氧 2020-05-13 …
漂白粉又称消毒粉,它是一种常见的消毒剂,广泛用于环境消毒杀菌。“漂白粉”的有效成分为次氯酸钙[化学 2020-05-13 …
用化学用语填空:(1)1个氧分子,2个氢原子,氧化铝(2)某新型消毒剂由Cl、O两种元素组成,且每 2020-07-24 …
下列关于生物武器的叙述,不确切的是()A.生物武器造价昂贵,但却是具有大规模杀伤性的武器B.生物武器 2020-11-22 …
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.(1)二氧化氯(ClO2)是国内外公 2020-11-22 …
消毒剂在公共场所进行卫生防疫时发挥着重要的作用。(1)氢氧化钠能杀灭细菌、病毒和寄生虫卵等,它的俗名 2020-11-23 …
消毒剂在公共场所进行卫生防疫时发挥着重要的作用.(1)氢氧化钠能杀灭细菌、病毒和寄生虫卵等,它的俗名 2020-11-23 …
下列有关生物武器的相关叙述,错误的是()A.生物武器种类包括致病菌、病毒、生化毒剂,以及经过基因重组 2020-12-07 …
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.(1)二氧化氯(ClO2)是国内外公 2020-12-18 …
据报道,2003年8月齐齐哈尔“8•4中毒事件”到目前确认已有43人中毒.经我国防化专家确认是侵华日 2021-01-05 …