早教吧作业答案频道 -->化学-->
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.(1)亚氯酸钠也
题目详情
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___.向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快.产生气体速率迅速加快的原因是___.
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2.用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是___.
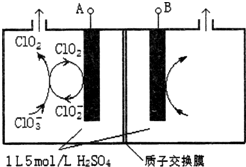
(3)电解法是目前研究最为热门的生产ClO2的方法之一.如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验.
①电源负极为___极(填A或B).
②写出阴极室发生反应依次为___.
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2-歧化反应.若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为___.

(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___.向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快.产生气体速率迅速加快的原因是___.
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2.用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是___.
(3)电解法是目前研究最为热门的生产ClO2的方法之一.如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验.
①电源负极为___极(填A或B).
②写出阴极室发生反应依次为___.
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2-歧化反应.若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为___.
▼优质解答
答案和解析
(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,故化合价由+3价升高到+4价,故部分氯离子降低为-1价,离子反应方程式为:5ClO2-+4H+=4ClO2↑+Cl-+2H2O,反应开始时,溶液中氯离子浓度很小,随着反应的进行,溶液中氯离子浓度增大,反应速率加快,可见氯离子起催化作用,
故答案为:5ClO2-+4H+=4ClO2↑+Cl-+2H2O;反应生成的Cl-对反应起催化作用;
(2)还可采用盐酸或双氧水还原氯酸钠制备ClO2,用H2O2作还原剂制备ClO2更受欢迎,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2,不会产生环境污染,
故答案为:H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2;
(3)①由图可知,ClO2在电极A上得到1个电子,生成ClO2-,故A应为电源的负极,
故答案为:A;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2,离子反应方程式为:ClO3-+ClO2-+2H+=2ClO2↑+H2O,
故答案为:ClO2+e-=ClO2-、ClO3-+ClO2-+2H+=2ClO2↑+H2O;
③在电解池的整个闭合回路中阴极得到的电子数等于阳极失去的电子数,在阳极室发生反应:4OH--4e-=O2↑+2H2O产生1mol的O2,转移4mold电子,阴极室的反应:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O,总反应为:4ClO3-+4e-+8H+=4ClO2↑+4H2O,转移4mol电子时,最终产生4mol的ClO2,共产生气体1mol+4mol=5mol,现在两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),产生气体的物质的量为1mol,所以转移电子0.8mol,在阳极有0.8mol的OH-离子放电,因为溶液的体积为1L,所以此时阳极室与阴极室c(H+)之差为0.8mol/L,
故答案为:0.8mol/L.
故答案为:5ClO2-+4H+=4ClO2↑+Cl-+2H2O;反应生成的Cl-对反应起催化作用;
(2)还可采用盐酸或双氧水还原氯酸钠制备ClO2,用H2O2作还原剂制备ClO2更受欢迎,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2,不会产生环境污染,
故答案为:H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2;
(3)①由图可知,ClO2在电极A上得到1个电子,生成ClO2-,故A应为电源的负极,
故答案为:A;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2,离子反应方程式为:ClO3-+ClO2-+2H+=2ClO2↑+H2O,
故答案为:ClO2+e-=ClO2-、ClO3-+ClO2-+2H+=2ClO2↑+H2O;
③在电解池的整个闭合回路中阴极得到的电子数等于阳极失去的电子数,在阳极室发生反应:4OH--4e-=O2↑+2H2O产生1mol的O2,转移4mold电子,阴极室的反应:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O,总反应为:4ClO3-+4e-+8H+=4ClO2↑+4H2O,转移4mol电子时,最终产生4mol的ClO2,共产生气体1mol+4mol=5mol,现在两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),产生气体的物质的量为1mol,所以转移电子0.8mol,在阳极有0.8mol的OH-离子放电,因为溶液的体积为1L,所以此时阳极室与阴极室c(H+)之差为0.8mol/L,
故答案为:0.8mol/L.
看了二氧化氯(ClO2)是国内外公...的网友还看了以下:
小李发现爷爷所服钙剂的主要成分是碳酸钙,于是想到在家中用钙剂与白醋(主要成分是醋酸)反应制取二氧化 2020-04-11 …
2011江苏高考19题高氯酸按(NHClO)是复合火箭推进剂的重要成分,实验室可通过下列反应制取高 2020-04-26 …
某固体清洁剂,其成分为火碱和纯碱(假设不含其他杂质).小聪想测定该固体清洁剂中火碱和纯碱的质量比. 2020-05-12 …
我家的304不锈钢洗浴室柜被洁厕剂腐蚀了,现在起锈了,请问应该怎么处理,可以让他不再生锈?不小心用 2020-05-16 …
以下关于颗粒剂的叙述,错误的是()A.颗粒剂可包衣B.可适当添加矫味剂等调节口感C.颗粒剂的含水量 2020-05-31 …
强氧化剂和强还原剂的反应强氧化剂与强还原剂的反应产物为弱氧化性的氧化产物和弱还原性的还原产物.那这 2020-06-07 …
下列有关实验方法或检测试剂的叙述,正确的是()A.用微电流计测量膜的静息电位时,要将微电流计的两极 2020-06-20 …
食品添加剂中的增味剂(635)是什么?可能是我说的不够准确,我不是问增味剂是什么,我想问的是编号为 2020-06-27 …
环磷酰胺是一种广谱抗肿瘤药物,该药物可与DNA发生交叉联结,抑制DNA合成,从而达到治疗肿瘤的效果 2020-07-02 …
市场上出售的许多食品中都含有添加剂.膨松剂就是食品添加剂中的一种,它加入面坯中,使面坯疏松或松脆, 2020-07-03 …