早教吧作业答案频道 -->化学-->
海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.(1)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收,这样做的目的是;碱吸收溴的
题目详情
海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是___;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为___ mol.
(2)海水提镁的一段
工艺流程如图:
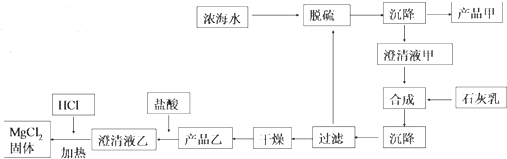
浓海水的主要成分如表:
①该工艺过程中,脱硫阶段主要的离子方程式为___,加入石灰乳时所发生的离子方程式是___
②产品乙的化学式为___,1L 浓海水最多可得到产品乙的质量是___
③在制备 MgCl2固体时,通入 HCl 气体的目的是___.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是___;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为___ mol.
(2)海水提镁的一段
工艺流程如图:

浓海水的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO
| ||
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品乙的化学式为___,1L 浓海水最多可得到产品乙的质量是___
③在制备 MgCl2固体时,通入 HCl 气体的目的是___.
▼优质解答
答案和解析
(1)吹出Br2,用SO2吸收,发生氧化还原反应生成硫酸和HBr,其目的是使Br2富集;Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中Br由0降低为-1,由0升高为+5价,可知吸收3mol溴转移5mol电子,则吸收0.15mol Br2时,转移的电子为0.15mol×
=0.25mol,
故答案为:使Br2富集;0.25;
(2)由流程可知,浓海水中利用钙离子将硫酸根离子转化为沉淀,得到产品甲为硫酸钙;滤液甲在合成步骤中加入石灰乳,将镁离子转化为沉淀,过滤、干燥后得到的产品乙为氢氧化镁沉淀,
①该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,加入石灰乳时所发生的离子方程式是Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+,
故答案为:Ca2++SO42-=CaSO4↓;Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+;
②由上述分析可知,产品乙为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×
=69.6g,
故答案为:Mg(OH)2;69.9g;
③氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl,为抑制氯化镁水解,应该在HCl气流中加热氯化镁晶体制备MgCl2固体,
故答案为:抑制氯化镁水解.
| 5 |
| 3 |
故答案为:使Br2富集;0.25;
(2)由流程可知,浓海水中利用钙离子将硫酸根离子转化为沉淀,得到产品甲为硫酸钙;滤液甲在合成步骤中加入石灰乳,将镁离子转化为沉淀,过滤、干燥后得到的产品乙为氢氧化镁沉淀,
①该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,加入石灰乳时所发生的离子方程式是Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+,
故答案为:Ca2++SO42-=CaSO4↓;Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+;
②由上述分析可知,产品乙为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×
| 58g |
| 24g |
故答案为:Mg(OH)2;69.9g;
③氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl,为抑制氯化镁水解,应该在HCl气流中加热氯化镁晶体制备MgCl2固体,
故答案为:抑制氯化镁水解.
看了海水是宝贵的自然资源,将海水淡...的网友还看了以下:
宝宝喝水竟然“水中毒”咋回事 宝宝补水先弄明白这些 2020-03-28 …
宝宝长水痘的起初症状 宝宝水痘期间请自觉隔离 2020-03-30 …
有一天小科同学把如图甲所示胶丸大小的珠子放在水里浸泡3天,结果变成了如图乙所示大珠子,大珠子俗称“ 2020-06-13 …
水是宝贵的自然资源.下列说法正确的是()A.自来水属于纯净物B.水广泛用于工农业生产C.为了节约用 2020-06-15 …
红楼梦中,贾宝玉对林黛玉说“任凭弱水三千,我只取一瓢饮.”黛玉道:“瓢之漂水奈何?”宝玉道:“非瓢 2020-06-29 …
哪位大虾帮忙翻译一段简单的文言?《红楼梦》第九十一回.宝玉呆了半晌,忽然大笑道:“任凭弱水三千,我 2020-07-02 …
调查报告《水,就这么浪费掉了》水是宝贵的自然资源,现在全世界有80多个国家约20亿人口正面临着水资源 2020-11-10 …
海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.(1)采用“空气 2020-11-20 …
海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.(1)采用“空气 2020-11-20 …
柳枝词郑文宝1“春潭”是水,自然无法“系”住,那么画舸到底“系”的是什么?请联系全诗,分析这样柳枝词 2020-12-15 …