早教吧作业答案频道 -->化学-->
物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.完成下列填空:(1)图1中X的水溶液在空气中放置易变浑浊,写
题目详情
物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.完成下列填空:
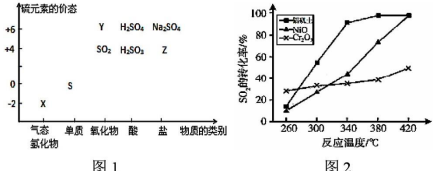
(1)图1中X的水溶液在空气中放置易变浑浊,写出反应的化学方程式:___;
(2)下列物质用于Na2S203制备,从氧化还原反应的角度分析,理论上有可能实现的方案是(选填编号)___.
a.Na2S+S b.Z+S C.Na2S03+Y d.NaHS+NaHS03
(3)请补充完整焙烧明矾的化学方程式:
___KAl(SO4)2.12H2O+___S═___K2SO4+___Al2O3+___SO2↑+___
(4)研究反应Na2S2O3+H2SO4=Na2SO4+S+SO2+H20的速率时,下列方案合理的是___.
a.测定一段时间内生成S02的体积,得出该反应的速率
b.研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c.用Na2S2O3(S)分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(5)治理含CO、SO2的烟道气,以铝钒土做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.己知:
①硫的熔点:112.8℃、沸点:444.6℃;
②反应每得到Imol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式___.
⑧一定条件下,将CO与SO2以体积比为4:1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是___(填写字母序号).
a.v (CO):v(SO2)=2:1 b.平衡常数不变
c.气体密度不变 d.C02和S02的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为
,则SO2的转化率为___.
(6)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选铝矾土做催化剂的主要原因是___.

(1)图1中X的水溶液在空气中放置易变浑浊,写出反应的化学方程式:___;
(2)下列物质用于Na2S203制备,从氧化还原反应的角度分析,理论上有可能实现的方案是(选填编号)___.
a.Na2S+S b.Z+S C.Na2S03+Y d.NaHS+NaHS03
(3)请补充完整焙烧明矾的化学方程式:
___KAl(SO4)2.12H2O+___S═___K2SO4+___Al2O3+___SO2↑+___
(4)研究反应Na2S2O3+H2SO4=Na2SO4+S+SO2+H20的速率时,下列方案合理的是___.
a.测定一段时间内生成S02的体积,得出该反应的速率
b.研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c.用Na2S2O3(S)分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(5)治理含CO、SO2的烟道气,以铝钒土做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.己知:
①硫的熔点:112.8℃、沸点:444.6℃;
②反应每得到Imol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式___.
⑧一定条件下,将CO与SO2以体积比为4:1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是___(填写字母序号).
a.v (CO):v(SO2)=2:1 b.平衡常数不变
c.气体密度不变 d.C02和S02的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为
| 7 |
| 11 |
(6)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选铝矾土做催化剂的主要原因是___.
▼优质解答
答案和解析
(1)X为H2S,H2S在空气中变浑浊是因为被氧气氧化为S,反应的化学方程式为2H2S+O2=2S↓+2H2O,
故答案为:2H2S+O2=2S↓+2H2O;
(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,bd符合题意,
故答案为:bd;
(3)由原子和元素守恒可知,缺项为水,反应中S元素的化合价由+6价降低为+4价,S元素的化合价由0升高为+4价,结合电子、原子守恒可知反应为4KAl(SO4)2•12H2O+3S
2K2SO4+2Al2O3+9SO2↑+48H2O,
故答案为:4;3;2;2;9;48H2O;
(4)根据硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,可以判断反应速率快慢,反应速率越快,出现浑浊时间越短,
故答案为:b;
(5)②反应每得到1mol硫,放出270kJ的热量,热化学方程式为2CO(g)+SO2(g)=S(l)+2CO2 (g)△H=-270kJ/mol,
故答案为:2CO(g)+SO2(g)=S(l)+2CO2 (g)△H=-270kJ/mol;
③a.CO和SO2的速率之比始终等于化学计量数之比,其无法判断反应是否达到平衡状态,故a错误;
b.温度不变平衡常数始终不变,平衡常数不变不能说明反应达到平衡状态,故b错误;
c.容器体积不变,S为固态,反应正向进行气体体积减小,当气体质量不变时,说明各组分浓度不变,反应达到平衡状态,故c正确;
d.CO2和SO2的体积比保持不变说明正逆反应速率相等,反应达到平衡状态,故d正确;
由 2CO(g)+SO2 (g)═S(s)+2CO2(g)
反应前(mol) 4 1 0 0
转化了(mol) 2x x x 2x
平衡后(mol) 4-2x 1-x x 2x
混合气体中CO的体积分数为
,则有
=
,x=0.6,
所以SO2的转化率为
×100%=60%,
故答案为:cd;60%.
(6)由图可知,生产中选铝钒土做催化剂的主要原因是铝钒土作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,能耗小,
故答案为:铝钒土作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,能耗小.
故答案为:2H2S+O2=2S↓+2H2O;
(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,bd符合题意,
故答案为:bd;
(3)由原子和元素守恒可知,缺项为水,反应中S元素的化合价由+6价降低为+4价,S元素的化合价由0升高为+4价,结合电子、原子守恒可知反应为4KAl(SO4)2•12H2O+3S
| ||
故答案为:4;3;2;2;9;48H2O;
(4)根据硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,可以判断反应速率快慢,反应速率越快,出现浑浊时间越短,
故答案为:b;
(5)②反应每得到1mol硫,放出270kJ的热量,热化学方程式为2CO(g)+SO2(g)=S(l)+2CO2 (g)△H=-270kJ/mol,
故答案为:2CO(g)+SO2(g)=S(l)+2CO2 (g)△H=-270kJ/mol;
③a.CO和SO2的速率之比始终等于化学计量数之比,其无法判断反应是否达到平衡状态,故a错误;
b.温度不变平衡常数始终不变,平衡常数不变不能说明反应达到平衡状态,故b错误;
c.容器体积不变,S为固态,反应正向进行气体体积减小,当气体质量不变时,说明各组分浓度不变,反应达到平衡状态,故c正确;
d.CO2和SO2的体积比保持不变说明正逆反应速率相等,反应达到平衡状态,故d正确;
由 2CO(g)+SO2 (g)═S(s)+2CO2(g)
反应前(mol) 4 1 0 0
转化了(mol) 2x x x 2x
平衡后(mol) 4-2x 1-x x 2x
混合气体中CO的体积分数为
| 7 |
| 11 |
| 4-2x |
| 4-2x+1-x+2x |
| 7 |
| 11 |
所以SO2的转化率为
| 0.6 |
| 1 |
故答案为:cd;60%.
(6)由图可知,生产中选铝钒土做催化剂的主要原因是铝钒土作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,能耗小,
故答案为:铝钒土作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,能耗小.
看了 物质的类别和核心元素的化合价...的网友还看了以下:
1.从直角的顶点引出一条射线把直角分成两个角使他们的度数之比是2:3其中较大角的度数是()2.在一 2020-05-23 …
陈莲河的诊金也是1元四角手骨朝花夕拾中的哪篇散文这篇中鲁迅对名医是什么态度为什么详写陈莲河药引陈莲 2020-06-12 …
如图,在三角形ABC中,角C=90度,若把三角形ABC沿直线DE折叠,使三角形ADE与三角形BDE 2020-06-27 …
1.把1个三角形分成15个以上的三角,至少要画几条线?2.有1串数:1,4,9,16,25,36… 2020-07-21 …
角在哪个象限(高一下P7)1)已知角顶点与直角坐标系原点重合,始边与X轴的非负半轴重合,指出下列是 2020-07-30 …
1已知角a的顶点与原点重合,始边与x轴的正半轴重合,终边在直线y=2x上,问cos2a=?cosa 2020-07-30 …
求高手指教三角形四心到三边距离之比的证明!三角形内心到a,b,c三边距离之比=1:1:1;三角形外 2020-07-30 …
图示为当前流行的农村庭院生态工程模式图,其生态系统各成分的组成和相互关系如图所示.回答下列问题:(1 2020-11-22 …
图1是某村子里的生态农业示意图,图2为矿区废弃地的生态恢复工程流程图,请据图回答有关问题:(1)生态 2020-11-23 …
英语句子提问1\重句时which比that等有什么不同的用法?2\hope,wish,want的用法 2020-11-26 …