早教吧作业答案频道 -->化学-->
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:(1)Y在元素
题目详情
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.
请回答下列问题:
(1)Y在元素周期表中的位置为___;
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是___(写化学式)
(3)W、Y、Z、G形成的简单离子的半径大小顺序是___(用化学符号表示)
(4)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___ (任写两个)
(5)Y与M的氢化物中,热稳定性差的是___(填化学式),沸点高的是___(填化学式)
(6)ZW的电子式为___,W2Y2的电子式为___,用电子式表示Z2M的形成过程:___.
(7)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,品红溶液___(填“褪色”或“不褪色”),请用相关离子方程式解释原因___.
(8)已知
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___.
(9)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N入出942kJ.根据以上信息和数据,下列说法正确的是___.
A.N4属于一种新型化合物
B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2
D.1molN4转变为N2将吸收882KJ的能量.
请回答下列问题:

(1)Y在元素周期表中的位置为___;
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是___(写化学式)
(3)W、Y、Z、G形成的简单离子的半径大小顺序是___(用化学符号表示)
(4)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___ (任写两个)
(5)Y与M的氢化物中,热稳定性差的是___(填化学式),沸点高的是___(填化学式)
(6)ZW的电子式为___,W2Y2的电子式为___,用电子式表示Z2M的形成过程:___.
(7)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,品红溶液___(填“褪色”或“不褪色”),请用相关离子方程式解释原因___.
(8)已知
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(9)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N入出942kJ.根据以上信息和数据,下列说法正确的是___.
A.N4属于一种新型化合物
B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2
D.1molN4转变为N2将吸收882KJ的能量.
▼优质解答
答案和解析
W、X、Y、Z、M、G五种短周期主族元素,原子序数依次增大.X元素的气态氢化物水溶液呈碱性,则X为氮元素;Y、M同主族,可形成MY2、MY3两种分子,则M为S元素、Y为氧元素;G原子序数大于S原子序数,则G为Cl元素;W、Z同主族,可形成离子化合物ZW,则W为H元素、Z为Na.
(1)Y为O元素,在元素周期表中的位置为:第二周期第VIA族,故答案为:第二周期第VIA族;
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Cl->N3->O2->Na+,
故答案为:Cl->N3->O2->Na+;
(4)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有:O3、Cl2、ClO2,故答案为:O3、Cl2、ClO2;
(5)非金属性O>S,故氢化物稳定性H2O>H2S,水分子之间存在氢键,水的沸点高于硫化氢的,故答案为:H2S;H2O;
(6)ZW为NaH,电子式为Na+[:H]-,H2O2的电子式为 ,用电子式表示Na2S的形成过程:
,用电子式表示Na2S的形成过程: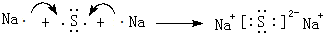 ,
,
故答案为:Na+[:H]-; ;
;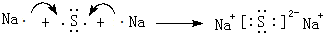 ;
;
(7)常温常压下若将相同体积的SO2和Cl2气体同时通入品红溶液,发生反应:SO2+Cl2+2H2O=SO42-+2Cl-+4H+,二者恰好反应,没有剩余,品红溶液不褪色,
故答案为:不褪色;SO2+Cl2+2H2O=SO42-+2Cl-+4H+;
(8)工业制镁时,电解MgCl2而不电解MgO的原因是:氧化镁熔点高,耗能多;制铝时,电解Al2O3而不电解AlCl3的原因是:氯化铝是共价化合物,熔融时不导电,
故答案为:氧化镁熔点高,耗能多;氯化铝是共价化合物,熔融时不导电;
(9)A.N4由N元素组成,是一种单质,故A错误;
B.N4晶体属于分子晶体,分子晶体的熔点一般较低,硬度较小,故B错误;
C.1molN4气体中含有0.6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,所以相同质量的N4的能量高于N2,故C正确;
D.1molN4气体中含有0.6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故D错误;
故选C.
(1)Y为O元素,在元素周期表中的位置为:第二周期第VIA族,故答案为:第二周期第VIA族;
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Cl->N3->O2->Na+,
故答案为:Cl->N3->O2->Na+;
(4)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有:O3、Cl2、ClO2,故答案为:O3、Cl2、ClO2;
(5)非金属性O>S,故氢化物稳定性H2O>H2S,水分子之间存在氢键,水的沸点高于硫化氢的,故答案为:H2S;H2O;
(6)ZW为NaH,电子式为Na+[:H]-,H2O2的电子式为
 ,用电子式表示Na2S的形成过程:
,用电子式表示Na2S的形成过程: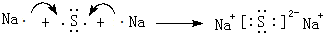 ,
,故答案为:Na+[:H]-;
 ;
;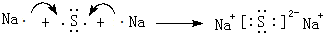 ;
;(7)常温常压下若将相同体积的SO2和Cl2气体同时通入品红溶液,发生反应:SO2+Cl2+2H2O=SO42-+2Cl-+4H+,二者恰好反应,没有剩余,品红溶液不褪色,
故答案为:不褪色;SO2+Cl2+2H2O=SO42-+2Cl-+4H+;
(8)工业制镁时,电解MgCl2而不电解MgO的原因是:氧化镁熔点高,耗能多;制铝时,电解Al2O3而不电解AlCl3的原因是:氯化铝是共价化合物,熔融时不导电,
故答案为:氧化镁熔点高,耗能多;氯化铝是共价化合物,熔融时不导电;
(9)A.N4由N元素组成,是一种单质,故A错误;
B.N4晶体属于分子晶体,分子晶体的熔点一般较低,硬度较小,故B错误;
C.1molN4气体中含有0.6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,所以相同质量的N4的能量高于N2,故C正确;
D.1molN4气体中含有0.6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故D错误;
故选C.
看了W、X、Y、Z、M、G五种短周...的网友还看了以下:
A、B、C、D、E五种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的 2020-04-08 …
有一种“上升数”,从左往右的数字依次增大,还有一种“下降数”,从左往右的数字依次减小,那么这四位数 2020-07-11 …
右图表示苹果生长发育时期几种激素的动态变化,图中甲、乙、丙三条曲线依次代表三种激素。下列说法正确的 2020-07-12 …
东周时期,一些重要的诸侯国比如齐国、晋国、楚国等仍然存在,说明西周时期传承下来的宗法制分封制依然发 2020-07-28 …
以下是我国经济重心变化示意图,与这三幅图相对应的大致时期依次是[]A.魏晋时期、唐朝中后期、南宋B 2020-07-28 …
(2014•荆州模拟)已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基 2020-11-12 …
山,水是自然界中的事物,而在我国文化中,它们的组合又带寓含某种理趣.请依照下面的例句另举一个带"山, 2020-11-21 …
依照下例句子仿写一个:我们期待黎明白就像农人期待春天,我们期待中途站就像期待依照下例句子仿写一个:我 2020-12-16 …
依据元素周期表及元素周期律,下列说法正确的是()A.原子最外层只有两个电子的元素一定属于金属元素B. 2020-12-20 …
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元 2021-01-05 …