早教吧作业答案频道 -->化学-->
举国震动的天津港爆炸事故过去近半年了.现已查明煤炸仓库涉及的危化品种类约40多种.一是氧化剂如硝酸铵等,二是易燃固体和遇湿易燃物品如金属钠、电石等,三是剧毐物如氰化钠(N
题目详情
举国震动的天津港爆炸事故过去近半年了.现已查明煤炸仓库涉及的危化品种类约40多种.一是氧化剂如硝酸铵等,二是易燃固体和遇湿易燃物品如金属钠、电石等,三是剧毐物 如氰化钠(NaCN)等.
I.【探究与反思】
(1)电石与饱和食盐水的反应式为___
(2)一定温度下,向pH=6的蒸溜水中加人0.23g金属钠,经充分反应后,再加蒸馏水至1L,所得溶液的pH为___
(3)硝酸铵溶液中离子浓度大小順序为___
(4)将10mL 0.9mol/L氯化铵溶液跟25mL 0.2mol/L氢氧化钡钡溶液混合,则混合后溶液中Ba2+、OH-、NH
、Cl-种离子浓度的大小顺序是___
II•【学习与问答】
学习下表并回答问甄:
(5)NaCN溶液呈碱性的原因是___(用离子方程式表示)
(6)下列有关反应的离子方程式或相关离子浓度关系正确的是___
A.2CN-+H20+CO2=2HCN+C0
B.2CH3C00H+CO
=2CH3COO-+H2O+CO2↓
C.浓度均为O.lmol•l-1的NaCN和Na2CO3溶液中,阴离子总浓度相等
D.在同一温度下pH均为10的Na2C03溶液、KaCN溶液中,水电离产生的c(0H-)相等
Ⅲ.【实验与探究】
装置如阁所示(省略夹持装置)
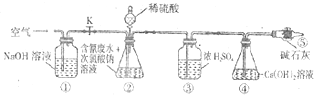
为了测定含氰化物水样中氰化物处理的百分率.将c(CN-)=0.2000 mol/L的氰化物物废水100mL与1OOmLNaClO溶液(过量)置于装置②锥形瓶中充分反应,打开分液漏斗活塞,滴入100mL稀H2SO4关闭活塞.
已知裝置②中发生的主要反应依次为:
CN-+ClO-═CNO-+Cl-
2CNO-+2H++3C10-═N2↑+2CO2↑+3C1-+H2O
(7)盛装碱石灰的仪器名称是___,装罝⑤的作用是___.
(8)为了计算锥形瓶废水中的氰化物被处理的百分率,实验中需要测定装置___(填装置序号)反应前后的质量
(9)在25℃时,若处理含NaCN废水时用NaOH溶液调节pH至9时,此时c(CN-)___c(HCN)(填“>”“<”或“=”)
I.【探究与反思】
(1)电石与饱和食盐水的反应式为___
(2)一定温度下,向pH=6的蒸溜水中加人0.23g金属钠,经充分反应后,再加蒸馏水至1L,所得溶液的pH为___
(3)硝酸铵溶液中离子浓度大小順序为___
(4)将10mL 0.9mol/L氯化铵溶液跟25mL 0.2mol/L氢氧化钡钡溶液混合,则混合后溶液中Ba2+、OH-、NH
| + 4 |
II•【学习与问答】
学习下表并回答问甄:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.75×10-5 | K1=5.0×10-10 | K1=4.4×lO-7 K2=4.7×10-11 |
(6)下列有关反应的离子方程式或相关离子浓度关系正确的是___
A.2CN-+H20+CO2=2HCN+C0
| 2- 3 |
B.2CH3C00H+CO
| 2- 3 |
C.浓度均为O.lmol•l-1的NaCN和Na2CO3溶液中,阴离子总浓度相等
D.在同一温度下pH均为10的Na2C03溶液、KaCN溶液中,水电离产生的c(0H-)相等
Ⅲ.【实验与探究】
装置如阁所示(省略夹持装置)

为了测定含氰化物水样中氰化物处理的百分率.将c(CN-)=0.2000 mol/L的氰化物物废水100mL与1OOmLNaClO溶液(过量)置于装置②锥形瓶中充分反应,打开分液漏斗活塞,滴入100mL稀H2SO4关闭活塞.
已知裝置②中发生的主要反应依次为:
CN-+ClO-═CNO-+Cl-
2CNO-+2H++3C10-═N2↑+2CO2↑+3C1-+H2O
(7)盛装碱石灰的仪器名称是___,装罝⑤的作用是___.
(8)为了计算锥形瓶废水中的氰化物被处理的百分率,实验中需要测定装置___(填装置序号)反应前后的质量
(9)在25℃时,若处理含NaCN废水时用NaOH溶液调节pH至9时,此时c(CN-)___c(HCN)(填“>”“<”或“=”)
▼优质解答
答案和解析
(1)电石与水反应生成氢氧化钙和乙炔化学方程式为:CaC2+2H2O→2Ca(OH)2+CH≡CH↑,故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)某温度时蒸馏水的pH=6,则水的离子积常数K=10-12,0.23gNa的物质的量=
=0.01mol,根据原子守恒得n(NaOH)=n(Na)=0.01mol,则c(NaOH)=
=0.01mol/L,c(H+)=
=10-10mol/L,则PH=10,
故答案为:10;
(3)硝酸铵溶液中铵根离子水解溶液显酸性,溶液中离子浓度大小为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)将10mL 0.9mol/L氯化铵溶液跟25mL 0.2mol/L氢氧化钡钡溶液混合,n(Cl-)=0.01L×0.9mol/L=0.009mol,n(Ba(OH)2)=0.025L×0.2mol/L=0.005mol,发生反应2NH4Cl+Ba(OH)2=BaCl2+2NH3•H2O,依据反应定量关系可知氢氧化钡剩余,溶液中Ba2+、OH-、NH4+、Cl-种离子浓度的大小顺序是:c(Cl-)>c(Ba2+)>c(OH-)>c(NH4+),
故答案为:c(Cl-)>c(Ba2+)>c(OH-)>c(NH4+);
(5)NaCN是强碱弱酸盐溶液,CN-离子水解溶液呈碱性,CN-+H2O⇌HCN+OH-,
故答案为:CN-+H2O⇌HCN+OH-;
(6)A.平衡常数可知碳酸酸性大于HCN,碳酸氢根离子电离平衡常数小于HCN;,反应的离子方程式为:CN-+H20+CO2=HCN+HC03-,故A错误;
B.醋酸酸性大于碳酸,大于碳酸氢根,反应离子方程式2CH3C00H+CO32-=2CH3COO-+H2O+CO2↑,故B正确;
C.碳酸根离子水解程度小于CN-,浓度均为O.lmol•L-1的NaCN和Na2CO3溶液中,阴离子总浓度不相等,故C错误;
D.在同一温度下pH均为10的Na2C03溶液、NaCN溶液中,阴离子水解促进水的电离,氢氧根离子浓度相同,水电离程度相同,故D正确;
故选BD,
故答案为:BD;
(7)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置④实验数据的测定产生干扰,装置⑤的作用是排除空气中二氧化碳对实验的干扰,
故答案为:干燥管;排除空气中二氧化碳对实验的干扰;
(8)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,则需要测定装置④反应前后的质量,
故答案为:④;
(9)处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),CN-+H2O⇌HCN+OH-,Ka(HCN)=5.0×10-10,Kh=
×
=
=
=2×10-5,c(OH-)=10-5,则
=2×10-5,则c(CN-)<c(HCN);
故答案为:<.
(2)某温度时蒸馏水的pH=6,则水的离子积常数K=10-12,0.23gNa的物质的量=
| 0.23g |
| 23g/mol |
| 0.01mol |
| 1L |
| 10-12 |
| 0.01 |
故答案为:10;
(3)硝酸铵溶液中铵根离子水解溶液显酸性,溶液中离子浓度大小为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)将10mL 0.9mol/L氯化铵溶液跟25mL 0.2mol/L氢氧化钡钡溶液混合,n(Cl-)=0.01L×0.9mol/L=0.009mol,n(Ba(OH)2)=0.025L×0.2mol/L=0.005mol,发生反应2NH4Cl+Ba(OH)2=BaCl2+2NH3•H2O,依据反应定量关系可知氢氧化钡剩余,溶液中Ba2+、OH-、NH4+、Cl-种离子浓度的大小顺序是:c(Cl-)>c(Ba2+)>c(OH-)>c(NH4+),
故答案为:c(Cl-)>c(Ba2+)>c(OH-)>c(NH4+);
(5)NaCN是强碱弱酸盐溶液,CN-离子水解溶液呈碱性,CN-+H2O⇌HCN+OH-,
故答案为:CN-+H2O⇌HCN+OH-;
(6)A.平衡常数可知碳酸酸性大于HCN,碳酸氢根离子电离平衡常数小于HCN;,反应的离子方程式为:CN-+H20+CO2=HCN+HC03-,故A错误;
B.醋酸酸性大于碳酸,大于碳酸氢根,反应离子方程式2CH3C00H+CO32-=2CH3COO-+H2O+CO2↑,故B正确;
C.碳酸根离子水解程度小于CN-,浓度均为O.lmol•L-1的NaCN和Na2CO3溶液中,阴离子总浓度不相等,故C错误;
D.在同一温度下pH均为10的Na2C03溶液、NaCN溶液中,阴离子水解促进水的电离,氢氧根离子浓度相同,水电离程度相同,故D正确;
故选BD,
故答案为:BD;
(7)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置④实验数据的测定产生干扰,装置⑤的作用是排除空气中二氧化碳对实验的干扰,
故答案为:干燥管;排除空气中二氧化碳对实验的干扰;
(8)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,则需要测定装置④反应前后的质量,
故答案为:④;
(9)处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),CN-+H2O⇌HCN+OH-,Ka(HCN)=5.0×10-10,Kh=
| c(OH-)c(HCN) |
| c(CN-) |
| c(H+) |
| c(H+) |
| Kw |
| Ka |
| 10-14 |
| 5×10-10 |
| c(HCN)×10-5 |
| c(CN-) |
故答案为:<.
看了举国震动的天津港爆炸事故过去近...的网友还看了以下:
某矿发生瓦斯煤尘爆炸,经查,是由于正在使用的煤电钻接线盒螺栓缺失,未及时处理造成的。其原因是该 2020-06-07 …
金属钠与酸反应会爆炸吗?如果会,与何种酸反应最易爆炸?参考资料上写金属钠与酸反应“先酸后水,反应剧 2020-06-29 …
(8分)亚硝酸钠属剧毒物质,是一种食品护色剂。人体摄入过多的亚硝酸钠,30min即出现恶心、呕吐、 2020-07-14 …
30%的氢氧化钠查表得密度为1.33,求其计算公式 2020-07-19 …
XRD分析方法分析氯化钠查阅文献针对一类具体材料结构分析方法的具体应用 2020-08-01 …
举国震动的天津港爆炸事故过去近半年了.现已查明煤炸仓库涉及的危化品种类约40多种.一是氧化剂如硝酸铵 2020-11-12 …
2015年8月12日晚11时20分左右天津爆炸事件中,其第二次爆炸更为剧烈,死亡惨重.其原因是消防官 2020-12-02 …
工业烧碱(NaOH)具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某化学学习小组同 2020-12-09 …
实验室中有一瓶标签受损的无色溶液,如图1所示,老师提示这是一瓶初中常用的溶液,要求同学们确认其溶质成 2020-12-10 …
某海港爆炸事故现场有少量氰化钠发生泄漏.因氰化钠有剧毒,消防人员通过喷洒双氧水的方式来处理这些泄露的 2020-12-10 …