早教吧作业答案频道 -->化学-->
实验室制备1-溴丁烷的原理为CH3CH2CH2CH2OH+NaBr+H2SO4△CH3CH2CH2CH2Br+NaHSO4+H2O,根据原理设计实验装置如图1所示.(1)仪器D的名称为,A处玻璃棒搅拌的目的是
题目详情
实验室制备1-溴丁烷的原理为CH3CH2CH2CH2OH+NaBr+H2SO4
CH3CH2CH2CH2Br+NaHSO4+H2O,根据原理设计实验装置如图1所示.
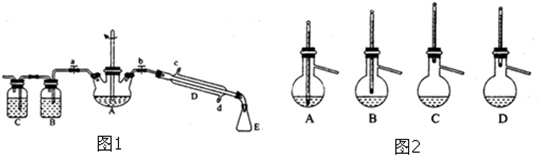
(1)仪器D的名称为,A处玻璃棒搅拌的目的是___.
(2)1-溴丁烷的制备反应中可能有:___、1-丁烷、溴化氢等副产物生成.熄灭A处酒精灯,打开a,余热会使反应继续进行.B、C装置可检验部分副产物,则判断B、C中应盛放的试剂分别是___、___.
(3)为了精制1-溴丁烷,待烧瓶冷却后,将A装置上的玻璃棒换成温度计,关闭a,打开b,使冷水从___(填“c”或“d”)处流入,粗产品蒸馏提纯时,图2 装置中温度计位置正确的是___(填字母,下同),可能会导致收集到的产品中混有低沸点杂质的装置是___.
(4)称取干燥、纯净的白色不容物7.36g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中,实验后装置A增重0.72g,装置B增重2.64g.白色不容物的化学式为___.
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式:___.
Ⅲ.反应原理分析
(6)NaHCO3 溶液中存在如下电离平衡:H2O⇌H++OH-、HCO3-⇌H++CO32-,从平衡移动角度分析实验①产生大量气泡和白色不容物的原因:___.
| △ |
| |

(1)仪器D的名称为,A处玻璃棒搅拌的目的是___.
(2)1-溴丁烷的制备反应中可能有:___、1-丁烷、溴化氢等副产物生成.熄灭A处酒精灯,打开a,余热会使反应继续进行.B、C装置可检验部分副产物,则判断B、C中应盛放的试剂分别是___、___.
(3)为了精制1-溴丁烷,待烧瓶冷却后,将A装置上的玻璃棒换成温度计,关闭a,打开b,使冷水从___(填“c”或“d”)处流入,粗产品蒸馏提纯时,图2 装置中温度计位置正确的是___(填字母,下同),可能会导致收集到的产品中混有低沸点杂质的装置是___.
(4)称取干燥、纯净的白色不容物7.36g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中,实验后装置A增重0.72g,装置B增重2.64g.白色不容物的化学式为___.
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式:___.
Ⅲ.反应原理分析
(6)NaHCO3 溶液中存在如下电离平衡:H2O⇌H++OH-、HCO3-⇌H++CO32-,从平衡移动角度分析实验①产生大量气泡和白色不容物的原因:___.
▼优质解答
答案和解析
(1)根据装置图可知仪器D为直形冷凝管,三颈烧瓶中反应物要充分混合,需要用玻璃棒搅拌,同时搅拌可加快反应速率,所以玻璃棒的作用为使反应物混合均匀并充分反应,提高反应速率,
故答案为:直形冷凝管;使反应物混合均匀并充分反应,提高反应速率;
(2)CH3CH2CH2CH2OH在浓硫酸条件下加热可以生成1-丁烯或丁醚等,所以可能有的杂质为丁醚等,图1中B、C可分别用来检验反应产生的气态产物溴化氢、1-丁烯,B中装硝酸银溶液或紫色石蕊试液用来检验溴化氢,C装置中装入溴水或酸性高锰酸钾溶液用来检验1-丁烯,
故答案为:丁醚;硝酸银溶液或紫色石蕊试液;溴水或酸性高锰酸钾溶液;
(3)根据冷却时采用逆流,冷却效果较好,所以冷水应从d处流入,蒸馏是温度计的水银球位置应与蒸馏烧瓶支管口平齐,所以D装置正确,如果低于蒸馏烧瓶支管口,则会收集到低沸点的物质,所以AB装置符合题意,
故答案为:d;D;AB;
(4)B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为2.64g,设碳酸镁的质量为x,则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
x 2.64g
x=
=5.04g,
所以氢氧化镁的质量为:7.36g-5.04g=2.32g,
氢氧化镁与碳酸镁的物质的量之比为:
:
=0.4mol:0.6mol=2:3,
则白色不溶物的化学式为:2Mg(OH)2•3MgCO3或Mg5(OH)4(CO3)3,
故答案为:2Mg(OH)2•3MgCO3或Mg5(OH)4(CO3)3;
(5)根据以上分析可知,镁与饱和碳酸氢钠溶液反应生成2Mg(OH)2•3MgCO3沉淀、Na2CO3和H2,反应的化学方程式为:5Mg+6NaHCO3+4H2O=2Mg(OH)2•3MgCO3↓+3Na2CO3+5H2↑,
故答案为:5Mg+6NaHCO3+4H2O=2Mg(OH)2•3MgCO3↓+3Na2CO3+5H2↑;
(6)NaHCO3溶液中存在平衡,HCO3-⇌H++CO32-、H2O⇌H++OH-,Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物Mg(OH)2•2MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行,
故答案为:Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物2Mg(OH)2•3MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行,实验Mg和饱和碳酸氢钠溶液产生大量气体和白色不溶物.
故答案为:直形冷凝管;使反应物混合均匀并充分反应,提高反应速率;
(2)CH3CH2CH2CH2OH在浓硫酸条件下加热可以生成1-丁烯或丁醚等,所以可能有的杂质为丁醚等,图1中B、C可分别用来检验反应产生的气态产物溴化氢、1-丁烯,B中装硝酸银溶液或紫色石蕊试液用来检验溴化氢,C装置中装入溴水或酸性高锰酸钾溶液用来检验1-丁烯,
故答案为:丁醚;硝酸银溶液或紫色石蕊试液;溴水或酸性高锰酸钾溶液;
(3)根据冷却时采用逆流,冷却效果较好,所以冷水应从d处流入,蒸馏是温度计的水银球位置应与蒸馏烧瓶支管口平齐,所以D装置正确,如果低于蒸馏烧瓶支管口,则会收集到低沸点的物质,所以AB装置符合题意,
故答案为:d;D;AB;
(4)B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为2.64g,设碳酸镁的质量为x,则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
x 2.64g
x=
| 2.64g×84 |
| 44 |
所以氢氧化镁的质量为:7.36g-5.04g=2.32g,
氢氧化镁与碳酸镁的物质的量之比为:
| 2.32g |
| 58g/mol |
| 5.04g |
| 84g/mol |
则白色不溶物的化学式为:2Mg(OH)2•3MgCO3或Mg5(OH)4(CO3)3,
故答案为:2Mg(OH)2•3MgCO3或Mg5(OH)4(CO3)3;
(5)根据以上分析可知,镁与饱和碳酸氢钠溶液反应生成2Mg(OH)2•3MgCO3沉淀、Na2CO3和H2,反应的化学方程式为:5Mg+6NaHCO3+4H2O=2Mg(OH)2•3MgCO3↓+3Na2CO3+5H2↑,
故答案为:5Mg+6NaHCO3+4H2O=2Mg(OH)2•3MgCO3↓+3Na2CO3+5H2↑;
(6)NaHCO3溶液中存在平衡,HCO3-⇌H++CO32-、H2O⇌H++OH-,Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物Mg(OH)2•2MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行,
故答案为:Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物2Mg(OH)2•3MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行,实验Mg和饱和碳酸氢钠溶液产生大量气体和白色不溶物.
看了实验室制备1-溴丁烷的原理为C...的网友还看了以下:
下列装置应用于实验室进行相关实验,能达到实验目的是()A.用装置甲在光照条件下验证甲烷与氯气的反应 2020-04-08 …
变限积分求道问题对函数f(t+h)-f(t-h)在[-h,h]上的积分对h求导.F(h)=∫[-h 2020-05-23 …
什么是译音用字?我在字典里查“呵”字,出现下面结果:您查询的字是:呵?多音字:hē,hā,ā(一) 2020-06-12 …
图1为“验证牛顿第二定律”实验装置的示意图.砂和砂桶的总质量为m,小车和砝码的总质量为M.实验中将 2020-06-29 …
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是△H=-393.5kJ/mol、△H= 2020-07-19 …
下列有关实验原理或实验操作正确的是()A.滴定实验中,滴定管用蒸馏水洗净后,必须干燥后方可使用B. 2020-07-29 …
(2013•沭阳县模拟)下列有关实验原理或实验操作正确的是()A.滴定实验中,滴定管用蒸馏水洗净后 2020-07-29 …
下列实验方案中,不能达到实验目的是()选项实验目的实验方案A检验溴乙烷是否发生消去反应溴乙烷与Na 2020-07-29 …
下列说法中正确的是A.N-C的键长比N-N的键长小B.H2O键角是180°,NH3是平面三角形C. 2020-07-31 …
某日报有题为“学校化学实验室也是污染源”的报道,文章指出:全国数以万计的高校、中学的化学实验室每天都 2020-11-17 …