早教吧作业答案频道 -->化学-->
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O实验内容及记录请回答:(1)根据上表中的实验数据,可以得到的结
题目详情
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验内容及记录
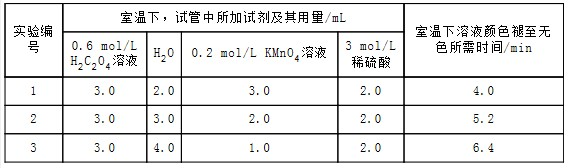
请回答:
(1)根据上表中的实验数据,可以得到的结论是___.
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=___.
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
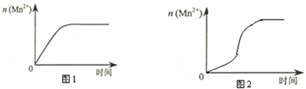
①该小组同学提出的假设是___.
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是___.
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为___;总方程式为___.
实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验内容及记录

请回答:
(1)根据上表中的实验数据,可以得到的结论是___.
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=___.
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
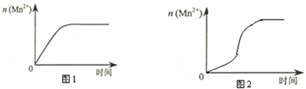
①该小组同学提出的假设是___.
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为___;总方程式为___.
▼优质解答
答案和解析
(1)从表中数据可知改变的条件是KMnO4浓度;其他条件相同时,增大KMnO4浓度,反应速率增大,
故答案为:其他条件相同时,增大KMnO4浓度反应速率增大;
(2)草酸的物质的量为:0.6mol•L-1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2mol•L-1×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0006mol=3:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:
=0.06mol/L,
这段时间内平均反应速率v(KMnO4)=
=1.5×10-2 mol/(L•min),
故答案为:1.5×10-2 mol/(L•min);
(3)①由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,
故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,
故答案为:MnSO4;
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,
故答案为:与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min);
(4)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为:2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:2MnO42--2e-=2MnO4-,总方程式为:2MnO42-+2H2O=2MnO4-+H2↑+2OH-,
故答案为:MnO42--e-=MnO4-;2MnO42-+2H2O=2MnO4-+H2↑+2OH-.
故答案为:其他条件相同时,增大KMnO4浓度反应速率增大;
(2)草酸的物质的量为:0.6mol•L-1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2mol•L-1×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0006mol=3:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:
| 0.2mol/L×0.003L |
| (3+2+3+2)×10-3L |
这段时间内平均反应速率v(KMnO4)=
| 0.06mol/L |
| 4min |
故答案为:1.5×10-2 mol/(L•min);
(3)①由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,
故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,
故答案为:MnSO4;
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,
故答案为:与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min);
(4)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为:2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:2MnO42--2e-=2MnO4-,总方程式为:2MnO42-+2H2O=2MnO4-+H2↑+2OH-,
故答案为:MnO42--e-=MnO4-;2MnO42-+2H2O=2MnO4-+H2↑+2OH-.
看了某化学小组为了研究外界条件对化...的网友还看了以下:
有一张厚度是0.1毫米的纸对折一次后厚度为0.2毫米,对折两次后,厚度为0.4毫米……假设连续对折 2020-05-13 …
看谁算行又对又快0.45÷0.05=4.3×0.5=1-0.08=600×0.01=0.65×1. 2020-05-17 …
收敛与有界比如数列{1/x}(x>0)这个数列是收敛于0把,但是这个数列不是只有上界没有下界么?有 2020-05-22 …
全血细胞分析报告单白细胞数5.5(4.0-10.0)淋巴细胞绝对值1.0(1.0-3.3)中间细胞 2020-06-05 …
某市对50户居民的家庭存款额进行了调查,数据如下(单位:万元)如下1.6,3.5,2.3,6.5, 2020-06-07 …
0.2缅币=2.3人民币,4.1人民币=0.4缅币,0.3缅币=3.45人民币对吗基数0.2缅币= 2020-07-06 …
log以0.4为底的0.5的对数和log以0.5为底的0.4的对数log以3为底的4的对数和log 2020-07-30 …
已知近似数2.50是用四舍五入法截得的,则下列结论正确的有:A,绝多误差界Δ=0.005;B,相对 2020-07-31 …
直接写数对又快.3.5×4=8.2+2.08=36÷0.01=99+1÷10=6-2.4×2=4÷0 2020-11-19 …
天空晴朗时,对于0.4-1.4微米的所有波长,在野外利用不同波段的遥感设备观测理想的常温黑体和同等温 2020-12-10 …