早教吧作业答案频道 -->化学-->
以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为[Fe2(OH)n(SO4)3-n/2]m}和绿矾(FeSO4•7H2O)具有成本低、反应快、产品质量高等优点.制备流程如图:(
题目详情
以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为[Fe2(OH)n(SO4)3-n/2]m}和绿矾(FeSO4•7H2O)具有成本低、反应快、产品质量高等优点.制备流程如图:
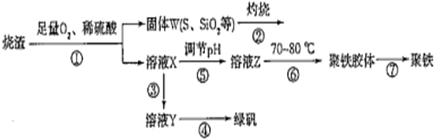
(1)流程图中溶液X为Fe(SO4)3溶液,据此写出操作①中属于氧化还原反应的离子方程式:___.
(2)操作②的处理存在弊端,该弊端是___.若固体W与KOH溶液混合加热,其中一个反应的化学方程式为3S+6KOH
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___.
(3)操作③需要加入的物质(试剂)是___,目的是___.
(4)操作⑤是使溶液pH___(填“增大”或“减小”).
(5)操作⑥控制温度为70-80℃的目的是___.
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe(OH)n(SO4)3-n/2,反应的化学方程式为___.

(1)流程图中溶液X为Fe(SO4)3溶液,据此写出操作①中属于氧化还原反应的离子方程式:___.
(2)操作②的处理存在弊端,该弊端是___.若固体W与KOH溶液混合加热,其中一个反应的化学方程式为3S+6KOH
| ||
(3)操作③需要加入的物质(试剂)是___,目的是___.
(4)操作⑤是使溶液pH___(填“增大”或“减小”).
(5)操作⑥控制温度为70-80℃的目的是___.
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe(OH)n(SO4)3-n/2,反应的化学方程式为___.
▼优质解答
答案和解析
硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁,烧渣加入稀硫酸通入足量的氧气发生反应生成铁盐溶液X,过滤得到固体为S,SiO2,灼烧得到二氧化硅;溶液X加入铁粉含有铁离子生成硫酸亚铁,蒸发浓缩冷却结晶得到绿矾晶体;溶液X调节溶液PH,加热促进铁离子的水解生成氢氧化铁胶体,得到聚铁胶体沉淀铁离子,处理得到聚铁;
(1)氧化还原反应的特征是元素的化合价的升降.发生的反应中属于氧化还原反应的为:4FeS+3O2+12H+=4Fe3++6H2O+4S;
故答案为:4FeS+3O2+12H+=4Fe3++6H2O+4S;
(2)在固体W中含有S、SiO2,在灼烧时S被氧化为SO2而逸出,导致环境污染.在反应3S+6KOH
2K2S+K2SO3+3H2O中,S既作氧化剂,也作还原剂,其中2个S作氧化剂,1个S作还原剂.所以该反应的氧化剂与还原剂质量之比为2:1;
故答案为:燃烧产物SO2会造成环境污染,2:1;
(3)溶液X为Fe(SO4)3,向其中加入Fe粉使硫酸铁还原为硫酸亚铁,然后蒸发、结晶得到绿矾;
故答案为:铁粉,使Fe3+还原为Fe2+;
(4)操作⑤是使溶液pH增大以促进Fe3+的水解,
故答案为:增大;
(5)操作⑥控制温度为70-80℃的目的是促进Fe3+水解,而又不至于Fe3+完全水解生成氢氧化铁胶体;
故答案为:促进Fe3+水解.又不至于Fe3+完全水解生成氢氧化铁胶体;
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2.根据电子守恒和质量守恒定律可得反应的化学方程式为:2FeSO4+H2O2+(1-
)H2SO4=Fe2(OH)n(SO4)3-n/2+(2-n)H2O;
故答案为:2FeSO4+H2O2+(1-
)H2SO4=Fe2(OH)n(SO4)3-n/2+(2-n)H2O;
(1)氧化还原反应的特征是元素的化合价的升降.发生的反应中属于氧化还原反应的为:4FeS+3O2+12H+=4Fe3++6H2O+4S;
故答案为:4FeS+3O2+12H+=4Fe3++6H2O+4S;
(2)在固体W中含有S、SiO2,在灼烧时S被氧化为SO2而逸出,导致环境污染.在反应3S+6KOH
| ||
故答案为:燃烧产物SO2会造成环境污染,2:1;
(3)溶液X为Fe(SO4)3,向其中加入Fe粉使硫酸铁还原为硫酸亚铁,然后蒸发、结晶得到绿矾;
故答案为:铁粉,使Fe3+还原为Fe2+;
(4)操作⑤是使溶液pH增大以促进Fe3+的水解,
故答案为:增大;
(5)操作⑥控制温度为70-80℃的目的是促进Fe3+水解,而又不至于Fe3+完全水解生成氢氧化铁胶体;
故答案为:促进Fe3+水解.又不至于Fe3+完全水解生成氢氧化铁胶体;
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2.根据电子守恒和质量守恒定律可得反应的化学方程式为:2FeSO4+H2O2+(1-
| n |
| 2 |
故答案为:2FeSO4+H2O2+(1-
| n |
| 2 |
看了以硫铁矿烧渣(含有氧化铁和少量...的网友还看了以下:
将一定量的氯气通入KBr溶液中,将一定量的氯气通入250mlKBr溶液中,反应完毕后将溶液蒸干并灼 2020-05-17 …
1在实验室制取氧气(碳酸钙与盐酸反应)的生成物中,不溶于水(即过滤后可得的固体残渣质量,另外,不溶 2020-05-20 …
一道简单的物质的量的计算,等你来抢分哦!将过量的铁粉投入含硫酸的硫酸铜溶液中充分反应后,把溶液过滤 2020-06-03 …
小坊同学在实验室用一定量的氯酸钾和二氧化锰混合物制取氧气,加热至固体质量不再减少时,称得固体残渣质 2020-06-24 …
某固体的样品组成中可能含有铁,硫酸铜,碳酸钙,硫酸钠,氯化钠.为探究其组成,进行如下实验①称取一定 2020-07-07 …
关于质量守恒定律的理解,错误的是()A.煤燃烧后灰渣质量小于煤,不能用质量守恒定律解释B.宏观:实际 2020-11-27 …
同学探究镀铜的铁画中铁元素在生铁中的含量进行如下实验:取一定质量含96%生铁的镀铜铁画边角料.将该边 2020-12-09 …
同学探究镀铜的铁画中铁元素在生铁中的含量进行如下实验:取一定质量含96%生铁的镀铜铁画边角料。将该边 2020-12-09 …
同学探究镀铜的铁画中铁元素在生铁中的含量进行如下实验:取一定质量含96%生铁的镀铜铁画边角料.将该边 2020-12-09 …
蛋白质中的含氮量是如何测定的一般认为蛋白质中的平均含氮量为16%,于是含氮量=蛋白质量*16%,蛋白 2021-01-12 …