早教吧作业答案频道 -->化学-->
甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景.工业上可用如下方法合成甲醇:方法一CO(g)+2H2(g)⇌CH3OH(g)方法二CO2(g)+3H2(g)⇌CH3O
题目详情
甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景.
工业上可用如下方法合成甲醇:
(1)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为___.
(2)方法一生产甲醇是目前工业上常用的方法.在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%.请回答下列问题:
①前5分钟内甲醇的平均反应速率为___;已知该反应在低温下能自发进行,则反应的△H为___(填“>”、“<”或“=”)0.
②在该温度下反应的平衡常数K=___.
③在图甲方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线.
(画在答题纸上)
④关于上述反应,下列叙述不正确的是___(填编号).
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.8molCO和0.6mol CH3OH,则此时v正>v逆
(3)方法二生产甲醇应更具前景,写出方法二生产甲醇的一个优点___.
(4)根据反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g),可利用CH3OH生产CH3OCH3.
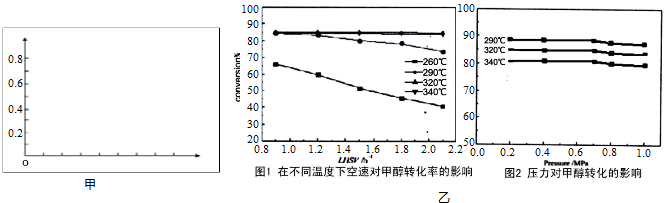
有人对甲醇脱水转化为二甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得图乙2幅图.
根据以上两幅图选择不受空速影响的合适反应温度和压强___.
(5)根据文献,甲醇生产二甲醚的转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇).若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率xM=___.
工业上可用如下方法合成甲醇:
| 方法一 | CO(g)+2H2(g)⇌CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) |
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为___.
(2)方法一生产甲醇是目前工业上常用的方法.在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%.请回答下列问题:
①前5分钟内甲醇的平均反应速率为___;已知该反应在低温下能自发进行,则反应的△H为___(填“>”、“<”或“=”)0.
②在该温度下反应的平衡常数K=___.
③在图甲方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线.

(画在答题纸上)
④关于上述反应,下列叙述不正确的是___(填编号).
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.8molCO和0.6mol CH3OH,则此时v正>v逆
(3)方法二生产甲醇应更具前景,写出方法二生产甲醇的一个优点___.
(4)根据反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g),可利用CH3OH生产CH3OCH3.
有人对甲醇脱水转化为二甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得图乙2幅图.
根据以上两幅图选择不受空速影响的合适反应温度和压强___.
(5)根据文献,甲醇生产二甲醚的转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇).若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率xM=___.
▼优质解答
答案和解析
(1):①2CH3OH(l)+3O2(g)⇌2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)⇌2CO2(g)△H=-566.0kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
由盖斯定律计算,(①-②-③×4)×
得到甲醇不完全燃烧生成CO和液态水的热化学反应方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(2)在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%,则
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.4 0.8 0.4
平衡量(mol/L) 0.1 0.2 0.4
①前5分钟内甲醇的平均反应速率=
=0.08mol/L•min;已知该反应在低温下能自发进行,△H-T△S<0,反应△S<0,则△H<0;
故答案为:0.08mol/(L•min);<;
②K=
=100,故答案为:100;
③根据以上三段式计算得,甲醇从反应开始到5min达平衡,浓度由0增大到0.4mol/L,所以甲醇的物质的量浓度随时间的变化曲线为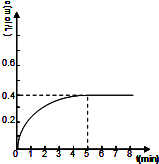 ,故答案为:
,故答案为: ;
;
④A.达到平衡时,移走部分甲醇,平衡将向右移动,反应物浓度减小,正反应速率减小,故A错误;
B.反应是气体体积减小的反应,缩小容器的体积,压强增大,平衡将向右移动,但c(CO)将变大,故B正确;
C.催化剂对正逆反应速率影响程度相同,在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂,故C正确;
D.若保持平衡时的温度和压强不变,再向容器中充入0.8molCO和0.6mol CH3OH,浓度商Q=
=35<K,平衡正向进行,则此时v正>v逆 ,故D正确;
故答案为:A;
(3)方法二生产甲醇消耗二氧化碳,有效控制温室效应,所以应更具前景,故答案为:减小二氧化碳的排放,有效控制温室效应;
(4)根据图1、图2可知,不受空速影响的合适反应温度为320℃、压强在0.2-0.6Mpa,
故答案为:320℃、0.2-0.6Mpa;
(5)设冷凝液总质量为mg,水的物质的量为:
mol,甲醇的物质的量为:
mol,
根据反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g)可知,生成
mol水,需要消耗甲醇的物质的量为:2×
mol,
甲醇的转化率为:xM=
=
,
故答案为:
②2CO(g)+O2(g)⇌2CO2(g)△H=-566.0kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
由盖斯定律计算,(①-②-③×4)×
| 1 |
| 2 |
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(2)在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%,则
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.4 0.8 0.4
平衡量(mol/L) 0.1 0.2 0.4
①前5分钟内甲醇的平均反应速率=
| 0.4mol/L |
| 5min |
故答案为:0.08mol/(L•min);<;
②K=
| 0.4 |
| 0.1×0.2 2 |
③根据以上三段式计算得,甲醇从反应开始到5min达平衡,浓度由0增大到0.4mol/L,所以甲醇的物质的量浓度随时间的变化曲线为
 ,故答案为:
,故答案为: ;
; ④A.达到平衡时,移走部分甲醇,平衡将向右移动,反应物浓度减小,正反应速率减小,故A错误;
B.反应是气体体积减小的反应,缩小容器的体积,压强增大,平衡将向右移动,但c(CO)将变大,故B正确;
C.催化剂对正逆反应速率影响程度相同,在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂,故C正确;
D.若保持平衡时的温度和压强不变,再向容器中充入0.8molCO和0.6mol CH3OH,浓度商Q=
0.4+
| ||
(0.1+
|
故答案为:A;
(3)方法二生产甲醇消耗二氧化碳,有效控制温室效应,所以应更具前景,故答案为:减小二氧化碳的排放,有效控制温室效应;
(4)根据图1、图2可知,不受空速影响的合适反应温度为320℃、压强在0.2-0.6Mpa,
故答案为:320℃、0.2-0.6Mpa;
(5)设冷凝液总质量为mg,水的物质的量为:
| m•C W |
| 18 |
| m•C M |
| 32 |
根据反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g)可知,生成
| m•C W |
| 18 |
| m•C W |
| 18 |
甲醇的转化率为:xM=
| ||||
|
| 32C W |
| 32C W+9C M |
故答案为:
| 32C W |
| 32C W+9C M |
看了甲醇是一种可再生能源,又是一种...的网友还看了以下:
给你几个字母,帮我拼个单词!R ,O,Y ,G ,G ,B ,P 给你这几个字母,帮我拼个单词(字 2020-05-16 …
钢水中FeO氧化C的反应是什么?如题,已知:(FeO)=Fe+[O][C]+(FeO)=CO(g) 2020-05-17 …
下列词语中,读音全都正确的一组是()A荼毒(tú)骀荡(tái)耄耋之年(mào)丢卒保车(chē 2020-06-10 …
判断下列各组单词括号内部分发音是否相同.h(o)td(o)g()cl(o)ckc(o)ffee() 2020-06-26 …
(2014•重庆模拟)已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放 2020-07-18 …
已知H2(g)+12O2(g)=H2O(l);△H=─285.8KJ/moL可通过两种途径来完成分 2020-07-19 …
算法设计中证明O(f)+O(g)=O(f+g) 2020-07-23 …
据报道,在小00℃、70uP你下由八氧化碳和氢气合成乙醇已成为现实.其反应如下:得了O得(g)+6s 2020-11-10 …
全是多选题钢化玻璃属于A.结构材料B.功能材料C.复合材料D.合成材料E.金属材料F.非金属材料G. 2020-11-20 …
外加剂含气量测定结果是对照自己标定曲线图还是对照说明书自带的曲线图骨料含气量是每次都侧还是就测一次或 2021-01-13 …
 扫描下载二维码
扫描下载二维码
