早教吧作业答案频道 -->化学-->
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-2CuCl+SnCl2═2CuCl↓+SnCl4
题目详情
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-
2CuCl+SnCl2═2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为___,H、N、O三种元素的电负性由大到小的顺序是___;
(2)SO2分子的空间构型为___;
(3)乙二胺分子中氮原子轨道的杂化类型为___,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是___.
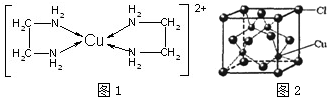
(4)如图1配离子[Cu(En)2]2+的配位数为___,该微粒含有的微粒间的作用力类型有___(填字母);
A.配位键 B.极性键 C.离子键 D.非极性键E.氢键 F.金属键
(5)CuCl的晶胞结构如图2所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为___.
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-
2CuCl+SnCl2═2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):

请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为___,H、N、O三种元素的电负性由大到小的顺序是___;
(2)SO2分子的空间构型为___;
(3)乙二胺分子中氮原子轨道的杂化类型为___,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是___.
(4)如图1配离子[Cu(En)2]2+的配位数为___,该微粒含有的微粒间的作用力类型有___(填字母);
A.配位键 B.极性键 C.离子键 D.非极性键E.氢键 F.金属键
(5)CuCl的晶胞结构如图2所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为___.
▼优质解答
答案和解析
(1)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9;
同周期自左而右,电负性增大,电负性O>N,H元素与O、N元素化合时,H元素表现正化合价,H元素的电负性比O、N元素小,故电负性O>N>H;
故答案为:3d9;O>N>H;
(2)SO2分子的中心原子S原子的杂化轨道数为
=3,采取sp2杂化,含有1对孤对电子对,故SO2为V型结构;
故答案为:V型;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高;
故答案为:sp3杂化;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4;
离子中存在配位键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故离子含有配位键、极性键、非极性键,故选ABD;
故答案为:4;ABD;
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+;故答案为:4.
同周期自左而右,电负性增大,电负性O>N,H元素与O、N元素化合时,H元素表现正化合价,H元素的电负性比O、N元素小,故电负性O>N>H;
故答案为:3d9;O>N>H;
(2)SO2分子的中心原子S原子的杂化轨道数为
| 6 |
| 2 |
故答案为:V型;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高;
故答案为:sp3杂化;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4;
离子中存在配位键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故离子含有配位键、极性键、非极性键,故选ABD;
故答案为:4;ABD;
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+;故答案为:4.
看了CuCl和CuCl2都是重要的...的网友还看了以下:
对电荷守恒定律的理解K2SO4==2K++SO42-MgSO4==Mg2++SO42-c(K+)+ 2020-05-13 …
设f(x)是定义在对称区间(-L,L)内的任何函数,证明……设f(x)是定义在对称区间(-L,L) 2020-05-16 …
写出下列算法的功能LinkListdemo(LinkListL){ListNode*q,*p;If 2020-05-17 …
某造纸厂排出废水,经取样分析其中除了含有游离汞,纤维素以及其他的有机物外,其他成分为c(Na+)= 2020-06-03 …
设函数f(x)是定义在(-L,L)内的奇函数(L〉0),证明若f(x)在(-L,0)内单调增加,则 2020-06-09 …
定义点P(x0,y0)到直线l:Ax+By+C=0(A2+B2≠0)的有向距离为d=Ax0+By0 2020-07-09 …
有Na2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的物质的量浓度为0.4mol/L,S 2020-07-22 …
篮球判罚问题2011/8/124:23:32,1防守队员在篮下垂直起跳,进攻队员上篮且已经完全腾空, 2020-11-22 …
用L,l,m表示k某种弹簧秤原来的长度为l,悬挂重物后的长度L可用公式L=l+k分之m表示某种弹簧秤 2020-12-05 …
下列关于人体免疫三道防线的说法不正确的是()A.人体的皮肤、黏膜等构成了人体的第一道防线B.体液中的 2020-12-05 …