早教吧作业答案频道 -->化学-->
氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一.(1)氨催化氧化法是工业制硝酸的主要方法.已知已知:2NO(g)+3H2(g)⇌2NH3(g)+O2(g)△H1=-272.9kJ•mol-1
题目详情
氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一.
(1)氨催化氧化法是工业制硝酸的主要方法.已知已知:2NO(g)+3H2(g)⇌2NH3(g)+O2(g)△H1=-272.9kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3=___.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)⇌2NH3(g)△H4=-92.4kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
K1___ K2(填“>”或“<”),其判断理由是___.
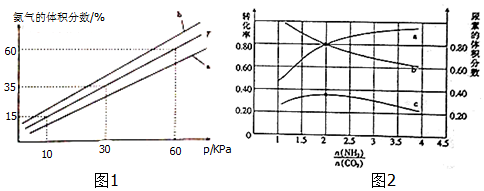
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是 (填字母).___
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为___.
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为___.
(5)氨碳比[n(NH3)/n(CaO2)]对合成尿素的反应:2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g)有影响.T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和比为3mol的NH3和CO2以不容的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数.[n(NH3)/n(CO2)]___时,尿素产量最大;该条件下反应的平衡常数K=___.

(1)氨催化氧化法是工业制硝酸的主要方法.已知已知:2NO(g)+3H2(g)⇌2NH3(g)+O2(g)△H1=-272.9kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3=___.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)⇌2NH3(g)△H4=-92.4kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
| 温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是 (填字母).___
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为___.
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为___.
(5)氨碳比[n(NH3)/n(CaO2)]对合成尿素的反应:2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g)有影响.T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和比为3mol的NH3和CO2以不容的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数.[n(NH3)/n(CO2)]___时,尿素产量最大;该条件下反应的平衡常数K=___.
▼优质解答
答案和解析
(1)已知:①2NO(g)+3H2(g)⇌2NH3(g)+O2(g)△H1=-272.9kJ•mol-1,②2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,②×3-①×2得到4NH3(g)+5O2(g)═4NO(g)+6H2O(g),根据盖斯定律△H3=2(-483.6kJ•mol-1)-2(-272.9kJ•mol-1)=-905.0KJ•mol-1,故答案为:-905.0KJ•mol-1;
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,K1>K2;故答案为:>;该反应为放热反应,温度升高,平衡逆向移动,平衡常数减小;
(3)①A.由图可知,温度一定时,压强增大氨气的体积分数增大,故A正确;
B.图B中T=500℃,合成氨是放热反应,压强一定时,降低温度平衡向正反应方向移动,平衡时氨气的体积分数增大,则温度为450℃时对应的曲线是b,故B正确;
C.500℃温度时反应速率加快及催化剂活性最好,正反应为放热反应,温度越低氮气的转化率越高,高温不利于氮气的转化,故C错误;
D.当 2v正(H2)=3v逆(NH3),不同物质表示的正逆速率之比等于化学计量数之比,说明可逆反应到达平衡,3v正(H2)=2v逆(NH3)时不能说明可逆反应到达平衡,故D错误;
故选:AB;
②设参加反应的氮气为n mol,则:
N2(g)+3H2(g)⇌2NH3(g)
开始(mol):10 40 0
转化(mol):n 3n 2n
平衡(mol):10-n 40-3n 2n
则
×100%=25%,解得n=5,所以氮气的转化率为
×100%=50%,
故答案为:AB;50%;
(4)由4NH3+5O2
4NO+6H2O、4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,则按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则生成1molHNO3、molH2O,则硝酸的质量分数为:
×100%=77.8%,
故答案为:77.8%;
(5)由图可知,横坐标为n(NH3):n(CO2)=2时,尿素的体积分数最大,且氨气的转化率为80%,
2NH3(g)+CO2(g)=CO(NH2)2(g)+H2O(g)
起始浓度(mol.L-1 ) 1 0.5 0 0
变化浓度(ol.L-1 ) 0.8 0.4 0.4 0.4
平衡浓度(mol.L-1 ) 0.2 0.1 0.4 0.4
该条件下反应的平衡常数K=
=40,
故答案为:2;40.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,K1>K2;故答案为:>;该反应为放热反应,温度升高,平衡逆向移动,平衡常数减小;
(3)①A.由图可知,温度一定时,压强增大氨气的体积分数增大,故A正确;
B.图B中T=500℃,合成氨是放热反应,压强一定时,降低温度平衡向正反应方向移动,平衡时氨气的体积分数增大,则温度为450℃时对应的曲线是b,故B正确;
C.500℃温度时反应速率加快及催化剂活性最好,正反应为放热反应,温度越低氮气的转化率越高,高温不利于氮气的转化,故C错误;
D.当 2v正(H2)=3v逆(NH3),不同物质表示的正逆速率之比等于化学计量数之比,说明可逆反应到达平衡,3v正(H2)=2v逆(NH3)时不能说明可逆反应到达平衡,故D错误;
故选:AB;
②设参加反应的氮气为n mol,则:
N2(g)+3H2(g)⇌2NH3(g)
开始(mol):10 40 0
转化(mol):n 3n 2n
平衡(mol):10-n 40-3n 2n
则
| 2n |
| 10-n+40-3n+2n |
| 5 |
| 10 |
故答案为:AB;50%;
(4)由4NH3+5O2
| ||
| △ |
| 63 |
| 63+18 |
故答案为:77.8%;
(5)由图可知,横坐标为n(NH3):n(CO2)=2时,尿素的体积分数最大,且氨气的转化率为80%,
2NH3(g)+CO2(g)=CO(NH2)2(g)+H2O(g)
起始浓度(mol.L-1 ) 1 0.5 0 0
变化浓度(ol.L-1 ) 0.8 0.4 0.4 0.4
平衡浓度(mol.L-1 ) 0.2 0.1 0.4 0.4
该条件下反应的平衡常数K=
| 0.4×0.4 |
| 0.1×0.22 |
故答案为:2;40.
看了氨是生产硝酸、尿素等物质的重要...的网友还看了以下:
有关学生体质健康评价指标规定:握力体重指数m=(握力÷体重)×100,初三男生的合格标准是m≥35 2020-05-13 …
有关学生体质健康评价指标规定:握力体重指标m=(握力/体重)×100,九年级男生的合格标准是m>= 2020-05-13 …
有关学生体质健康评价指标规定:握力体重指数m=(握力÷体重)×100,初三男生的合格标准是m≥35 2020-05-13 …
写一篇简短的英语拒绝邀请信.具体的内容是m先生在圣诞节举办了一个派对要请你参加,但是你在那天正好要 2020-05-23 …
从39.2m高处水平发射一颗子弹,经s子弹落地;若初速度是500m/s,子弹通过的水平距离是m;落 2020-05-23 …
如何生成一个只由0和1组成的满秩矩阵?设我需要生成一个n行m列的矩阵(其中n>m),要求:1、该矩 2020-06-16 …
第四节:书面表达(满分15分)假设你叫李华,你校高一同学正在开展一场讨论,主题是:学生要不要参加体 2020-07-06 …
“有志者,事竞成,破釜沉舟,百二秦关终属楚;苦心人,天不负,卧薪尝胆,三千越甲可吞吴。”这句话给我 2020-07-12 …
数学问题在日常生活中如取款、上网等都需要密码.有一种用因式分解法产生的密码,方便记忆.原理是:如对 2020-08-03 …
这个作业怎么做?书面表达.书面表达.假设你叫李华,你校高一同学正在开展一场讨论,主题是:学生要不要参 2020-11-01 …