早教吧作业答案频道 -->化学-->
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙
题目详情
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C 的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2:1的离子化合物丙.
(1)D的原子结构示意图为___,丙的电子式为___;E在周期表中的位置为___;
(2)下列说法正确的有___;
①化合物乙分子中只含有极性共价键
②C、D、E、F离子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应___;
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式___.
(1)D的原子结构示意图为___,丙的电子式为___;E在周期表中的位置为___;
(2)下列说法正确的有___;
①化合物乙分子中只含有极性共价键
②C、D、E、F离子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应___;
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式___.
▼优质解答
答案和解析
A、B、C、D、E、F为短周期元素,且原子序数依次增大,A是原子半径最小的元素,则A为H元素;B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲,则为B为N元素,甲为NH4NO3;E与B同主族,则E为P元素;C的阳离子与F的阴离子相差一个电子层,结合原子序数可知,C、D均处于第三周期,F原子序数大于P,且可形成阳离子、阴离子个数比为2:1的离子化合物丙,故F为S、C为Na、丙为Na2S;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,则D为Si、乙为SiH4,
(1)D为Si,原子结构示意图为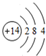 ,丙为Na2S,电子式为
,丙为Na2S,电子式为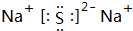 ,E为P元素,在周期表中的位置为:第三周期VA族,
,E为P元素,在周期表中的位置为:第三周期VA族,
故答案为: ;
;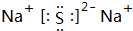 ;第三周期VA族;
;第三周期VA族;
(2))①乙为SiH4,分子只含有极性共价键,故正确;
②钠离子比气体非金属离子少一个电子层,离子半径最小,故错误;
③非金属性B(N)>E(P),故B的氢化物更稳定,故正确;
④甲为NH4NO3,含有离子键、共价键,丙为Na2S,只含有离子键,故错误,
故答案为:①③;
(3)SO2通入BaCl2和HNO3的混合溶液中,HNO3将SO2氧化为SO42-,NO3-本身被还原为NO,SO42-与Ba2+结合生成白色沉淀,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+;
(4)以上元素组成的10电子微粒有NH3、Na+、NH4+,18电子微粒有SiH4、PH3、H2S、HS-、S2-.能相互反应的有2NH3+H2S═2NH4++S2-或NH3+HS-═NH4++S2-或NH3+H2S═NH4++HS-,
故答案为:2NH3+H2S═2NH4++S2-或NH3+HS-═NH4++S2-或NH3+H2S═NH4++HS-.
(1)D为Si,原子结构示意图为
 ,丙为Na2S,电子式为
,丙为Na2S,电子式为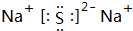 ,E为P元素,在周期表中的位置为:第三周期VA族,
,E为P元素,在周期表中的位置为:第三周期VA族,故答案为:
 ;
;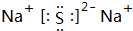 ;第三周期VA族;
;第三周期VA族;(2))①乙为SiH4,分子只含有极性共价键,故正确;
②钠离子比气体非金属离子少一个电子层,离子半径最小,故错误;
③非金属性B(N)>E(P),故B的氢化物更稳定,故正确;
④甲为NH4NO3,含有离子键、共价键,丙为Na2S,只含有离子键,故错误,
故答案为:①③;
(3)SO2通入BaCl2和HNO3的混合溶液中,HNO3将SO2氧化为SO42-,NO3-本身被还原为NO,SO42-与Ba2+结合生成白色沉淀,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+;
(4)以上元素组成的10电子微粒有NH3、Na+、NH4+,18电子微粒有SiH4、PH3、H2S、HS-、S2-.能相互反应的有2NH3+H2S═2NH4++S2-或NH3+HS-═NH4++S2-或NH3+H2S═NH4++HS-,
故答案为:2NH3+H2S═2NH4++S2-或NH3+HS-═NH4++S2-或NH3+H2S═NH4++HS-.
看了A、B、C、D、E、F均为短周...的网友还看了以下:
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图为超氧化钾晶体的一 2020-04-08 …
超氧化钾结构看了一些解释说是离子内有一个σ键和一个3电子π键.这样一个氧周围不就9个电子了吗?这样 2020-06-05 …
①双氧水分解②通电分解水③过氧化钠+二氧化碳生成碳酸钠+氧气最适合潜水艇制取氧气的方法是----与 2020-06-12 …
0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72LH2.等量的R元素的单质与足 2020-06-27 …
人体细胞中的某基因活化后,导致细胞癌变.相关推测最合理的是()A.该基因基本组成单位是脱氧核糖核酸 2020-07-01 …
1.还原46.4克某金属R的氧化物可得该金属36.8克,已知该金属的原子量为184.则此氧化物是? 2020-07-18 …
0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72LH2.等量的R元素的单质与足量 2020-11-24 …
懂化学的老师进来一下!什么气体与氧气混合爆炸威力最大?丁烷与氧气混合的比例达到多少,爆炸威力最大?丁 2020-11-28 …
将离体的线粒体放在无氧的环境中,经过一段时间以后,其内膜上的呼吸链的成分将会完全以还原形式存在,这时 2020-12-26 …
下面是全校学生一周内每天到图书室借书人数的统计.周一周二周三周四周五合计人数199145203210 2021-01-13 …