早教吧作业答案频道 -->化学-->
利用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料(MnCO3)及纯净的氯化铜晶体(CuCl2•2H2O).工业流程如图:已知:几种金属离子沉淀的pH如表金属离子Fe2+
题目详情
利用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料(MnCO3)及纯净的氯化铜晶体(CuCl2•2H2O).工业流程如图:
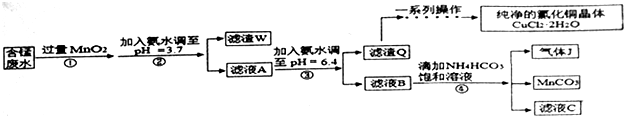
已知:几种金属离子沉淀的pH如表
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为___
(2)过程②中,所得滤渣W的成分是___.
(3)过程③中,调pH=6.4目的是___.
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是___.
(5)将滤渣Q溶解在过量的盐酸中,经过___,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O).
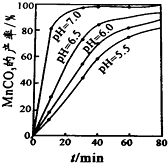
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如图据图中信息,你选择的最佳pH是___;理由是___.
(7)从滤液C可得到的副产品是___(填化学式).

已知:几种金属离子沉淀的pH如表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为___
(2)过程②中,所得滤渣W的成分是___.
(3)过程③中,调pH=6.4目的是___.
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是___.
(5)将滤渣Q溶解在过量的盐酸中,经过___,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O).
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如图据图中信息,你选择的最佳pH是___;理由是___.

(7)从滤液C可得到的副产品是___(填化学式).
▼优质解答
答案和解析
酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)加过量MnO2,将Fe2+氧化为Fe3+,加氨水调节pH,Fe3+转化为Fe(OH)3沉淀,过滤,滤渣为Fe(OH)3和过量的MnO2,滤液A含有Mn2+、Cl-、H+、Cu2+,加氨水调节pH=6.4,...
看了利用酸性含锰废水(主要含Mn2...的网友还看了以下:
在高度集中的计划经济体制下,人们的职业道德通常表现为( )。A.功利性和竞争性B.公开性和利他性C. 2020-05-22 …
某制品厂,现有鲜葡萄9t,若在销售市场上直接销售,每吨可获利500元;若制成饮料销售每吨可获利12 2020-07-06 …
某制品厂,现有鲜葡萄9吨,若在市场上直接销售,每吨可获利500元;若制成饮料销售每吨可获利1200 2020-07-06 …
江海里的航标灯要求夜晚亮、白天熄.人们利用半导体的有关特性制成了能自动点亮、熄灭的航标灯装置,实现 2020-07-06 …
我国现在所实行的分配制度具有巨大的优越性,主要体现在()①有利于发挥收入分配的激励作用,调动人们的 2020-07-20 …
利用实验装置进行相关操作,不能达到相应实验目的是()ABCD证明浓硫酸具有脱水性、氧化性制备并收集 2020-07-21 …
半导体的导电能力介于之间.根据半导体对光敏感的特性可制成光敏电阻,那么根据半导体对温度敏感的特性可制 2020-11-28 …
李鸿章说:“中国欲自强,则莫如学习外国利器;欲学习外国利器,则莫如觅制利器之器。”为此,他创办了A. 2020-12-07 …
李鸿章说:“中国欲自强,则莫如学习外国利器;欲学习外国利器,则莫如觅制利器之器。”以下工业,符合李鸿 2020-12-07 …
惯性制导是利用惯性原理控制和导引导弹(或运载火箭)飞向目标的技术,工作时不依赖外界信息,也不向外辐射 2021-01-13 …