早教吧作业答案频道 -->化学-->
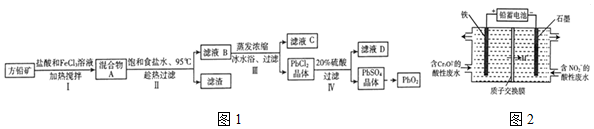
铅蓄电池有广泛的应用,由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如图1:査阅资料:①PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为
题目详情
铅蓄电池有广泛的应用,由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如图1:
査阅资料:①PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为___;
加入盐酸控制pH小于1.0的原因是___.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是___、___.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是___(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有___(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是___
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为___ mol.

査阅资料:①PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
加入盐酸控制pH小于1.0的原因是___.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是___、___.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是___(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有___(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是___
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为___ mol.
▼优质解答
答案和解析
(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为:PbS+2FeCl3=PbCl2+2FeCl2+S;铁离子易水解诶,加入盐酸控制pH小于1.0可以抑制 Fe3+ 的水解;
故答案为:PbS+2FeCl3=PbCl2+2FeCl2+S;抑制 Fe3+ 的水解;
(2)根据PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0,含有PbCl2的混合物A浸泡溶解时采用95℃和饱和食盐水可以加快浸泡速率增大PbCl2在氯化钠溶液中的溶解度;
故答案为:加快浸泡速率;增大PbCl2在氯化钠溶液中的溶解度;
(3)根据题意:存在PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0,用冰水浴使反应PbCl2(s)+2Cl- (aq)⇌PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
故答案为:冰水浴使反应PbCl2(s)+2Cl- (aq)⇌PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
(4)用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,需要的仪器有量筒、烧杯、玻璃棒;
故答案为:ABE;
(5)①在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②阴极的反应为8H++2NO2-+6e-=N2+H2O,当阴极区消耗2mol NO2-时,转移电子为6mol,减少8molH+,阳极Fe-2e-=Fe2+,得到3molFe2+,6mol正电荷,故有6mol右池减少的6molH+转移到右池,故右池减少的H+的物质的量为2mol;
故答案为:2.
故答案为:PbS+2FeCl3=PbCl2+2FeCl2+S;抑制 Fe3+ 的水解;
(2)根据PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0,含有PbCl2的混合物A浸泡溶解时采用95℃和饱和食盐水可以加快浸泡速率增大PbCl2在氯化钠溶液中的溶解度;
故答案为:加快浸泡速率;增大PbCl2在氯化钠溶液中的溶解度;
(3)根据题意:存在PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0,用冰水浴使反应PbCl2(s)+2Cl- (aq)⇌PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
故答案为:冰水浴使反应PbCl2(s)+2Cl- (aq)⇌PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
(4)用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,需要的仪器有量筒、烧杯、玻璃棒;
故答案为:ABE;
(5)①在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②阴极的反应为8H++2NO2-+6e-=N2+H2O,当阴极区消耗2mol NO2-时,转移电子为6mol,减少8molH+,阳极Fe-2e-=Fe2+,得到3molFe2+,6mol正电荷,故有6mol右池减少的6molH+转移到右池,故右池减少的H+的物质的量为2mol;
故答案为:2.
看了铅蓄电池有广泛的应用,由方铅矿...的网友还看了以下:
我们生活中离不开各种各样的电池,下列关于电池的说法错误的是()A.用后不能再生的电池称为一次电池, 2020-05-13 …
镍氢电池充电和电解液的问题1.使用半年的镍氢电池有1.2V电压,但充不进电,测量无短路电流(8-2 2020-05-17 …
我们生活中离不开各种各样的电池,下列关于电池的说法错误的是()A.用后不能再生的电池称为一次电池, 2020-06-14 …
1.某电子点火器用的是1号干电池,某袖珍收音机用的是7号电池.新的1号干电池和7号干电池的电动势是 2020-06-22 …
(2013•淄博)如图所示的是一种太阳能路灯的电路示意图,光控开关S白天与a点接触,太阳能电池板给 2020-06-25 …
镍氢电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。镍氢电池的总反应式是:H2+ 2020-07-12 …
电池充电器充1颗和2颗电流算多少?电池充电器上标输出:1.2vdc240maAA120ma*1AA 2020-07-29 …
测得蓄电池开路电压为2V,下列结论正确的是A;该电池的电动势大于2VB;该电池的电动势小于2VC;电 2020-11-15 …
美国NASA曾开发一种铁-空气二次电池.该电池放电时,其原理如图所示,电池反应为:2Fe+O2+2H 2021-01-14 …
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e- 2021-01-24 …