早教吧作业答案频道 -->化学-->
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:根据以上工艺回答下列问题:(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:阳极
题目详情
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
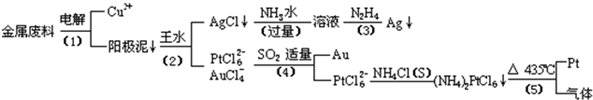
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:
阳极:___;
阴极:___;
(2)写出步骤(4)的离子反应方程式:___;
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:___.

根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:
阳极:___;
阴极:___;
(2)写出步骤(4)的离子反应方程式:___;
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:___.
▼优质解答
答案和解析
(1)金属废料中含银、铜、金和铂,利用电解原理分类应用,结合金属精炼原理分析可知,金属废料做电解池阳极,其中铜失电子发生氧化反应:Cu-2e-=Cu2+;铜离子在阴极得到电子生成Cu,Cu2++2e-=Cu,工作一段时间后测得导线上通过了3.01×1024个e-,则电子的物质的量为5mol,
根据Cu2++2e-=Cu可知,转移5mol电子生成2.5molCu,所以生成Cu的质量为2.5mol×64g/mol=160g;
故答案为:Cu-2e-=Cu2+;Cu2++2e-=Cu;
(2)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,依据氧化还原反应的电子守恒分析计算写出离子方程式为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H,
故答案为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;
(3)金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水;
故答案为:王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水.
根据Cu2++2e-=Cu可知,转移5mol电子生成2.5molCu,所以生成Cu的质量为2.5mol×64g/mol=160g;
故答案为:Cu-2e-=Cu2+;Cu2++2e-=Cu;
(2)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,依据氧化还原反应的电子守恒分析计算写出离子方程式为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H,
故答案为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;
(3)金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水;
故答案为:王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水.
看了从含银、铜、金和铂的金属废料中...的网友还看了以下:
关于验电器与金属的一个问题金属内有自由电子在移动,而验电器的原理又是当带电体触碰验电器的金属球时,部 2020-03-31 …
阅读下面文字,完成问题。一切艺术作品的创作都是人物形象的创造,动画电影作为电影的一个类型,它同样具 2020-05-12 …
1对于在静电平衡问题上用导线将某带电金属球与另带电一金属球相连并将其中一个与金属壳内部相接触,那么 2020-05-13 …
关于金属的问题金属原子最外层电子都是离域的(参与金属键的形成),还是每个金属原子最外层只有一个电子 2020-06-25 …
1895年底,法国人卢米埃尔首次放映电影短片,这标志着电影艺术的诞生.在当今世界,影响最大的电影奖 2020-07-02 …
请问烫金板的制作材料是什么,及工艺制作,用什么样的化学药水腐蚀的快又深?比例是多少要做烫金板,但不 2020-07-06 …
谁来帮我解决一下电场和电势的问题:均匀带电金属球壳和金属球体内外各自的电场和电势如何分析?重谢!. 2020-07-31 …
2013年9月7日,由中国电视艺术家协会和中国农业电影电视中心(CCTV—7农业频道)联合主办的“金 2020-11-07 …
电容请问90n工艺,MIM电容为什么不能做在两层厚金属之间啊?而一定要做在Mx和Mn之间? 2020-12-01 …
英语翻译《艺苑问道――仲呈祥自选集》《电视传播的艺术》《影视艺术前沿――影视本体和走向论》《电视艺术 2021-01-01 …