早教吧作业答案频道 -->化学-->
软锰矿(主要成份为MnO2)可用于制备锰及其化合物,如图为现代冶炼软锰矿制化学纯MnO2的工艺流程图.(1)软锰矿还能在C6H12O6和50%的H2SO4条件下还原浸出得到MnSO4,写出该反应的离子方程
题目详情
软锰矿(主要成份为MnO2)可用于制备锰及其化合物,如图为现代冶炼软锰矿制化学纯MnO2的工艺流程图.
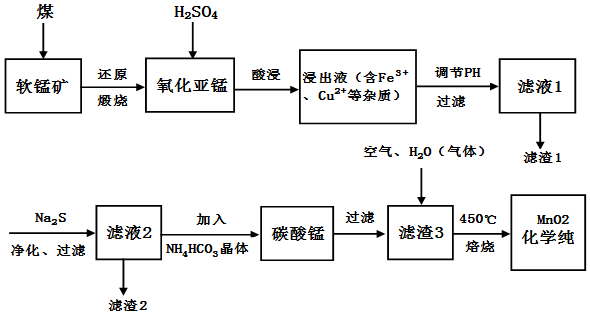
(1)软锰矿还能在C6H12O6和50%的H2SO4条件下还原浸出得到MnSO4,写出该反应的离子方程式:___,同上述流程相比此法的优点是___.
(2)写出能提高氧化亚锰(MnO)浸出率的措施:___.
(3)滤渣1和滤渣2分别为___、___(填化学式).
(4)写出滤液2加入NH4HCO3晶体制碳酸锰的化学方程式___;写出由滤渣3制化学纯MnO2的化学方程式___.
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)⇌Mn(OH)2(s)+CO
(aq),t℃时,计算该反应的平衡常数K=___.(填数值)
(6)剩余的MnCO3及低价氧化亚锰,经H2SO4溶出,氯酸钠重质化,再经洗涤,烘干也可制得化学纯MnO2(过程中会有黄绿色气体放出),写出该反应的离子方程式___.

(1)软锰矿还能在C6H12O6和50%的H2SO4条件下还原浸出得到MnSO4,写出该反应的离子方程式:___,同上述流程相比此法的优点是___.
(2)写出能提高氧化亚锰(MnO)浸出率的措施:___.
(3)滤渣1和滤渣2分别为___、___(填化学式).
(4)写出滤液2加入NH4HCO3晶体制碳酸锰的化学方程式___;写出由滤渣3制化学纯MnO2的化学方程式___.
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)⇌Mn(OH)2(s)+CO
| 2- 3 |
(6)剩余的MnCO3及低价氧化亚锰,经H2SO4溶出,氯酸钠重质化,再经洗涤,烘干也可制得化学纯MnO2(过程中会有黄绿色气体放出),写出该反应的离子方程式___.
▼优质解答
答案和解析
(1)软锰矿与C6H12O6和50%的H2SO4条件下生成MnSO4,锰元素化合价降低,则碳元素化合价升高生成二氧化碳,反应为:12MnO2+24H++C6H12O6=12Mn2++6CO2+18H2O;该方法能耗低、操作更简便、转化率高;
故答案为:12MnO2+24H++C6H12O6=12Mn2++6CO2+18H2O;能耗低、操作更简便、转化率高;
(2)适当升高反应体系温度,及适当增大H2SO4浓度可提高氧化亚锰(MnO)浸出率;
故答案为:适当升高反应体系温度,及适当增大H2SO4浓度;
(3)浸出液含有Fe3+、Cu2+等杂质,调节溶液的pH,将 Fe3+以Fe(OH)3沉淀下来,向滤液中加入硫化钠,可以将铜离子形成硫化物沉淀下来,故滤渣1为Fe(OH)3;滤渣2为CuS;
故答案为:Fe(OH)3;CuS;
(4)滤液2主要成分为硫酸锰,加入NH4HCO3晶体生成碳酸锰、硫酸铵、二氧化碳和水,反应为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;碳酸锰高温下被氧气氧化为二氧化锰,反应为:2MnCO3+O2
MnO2+2CO2;
故答案为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;2MnCO3+O2
MnO2+2CO2;
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,反应MnCO3(s)+2OH-(aq)⇌Mn(OH)2(s)+CO32-(aq),平衡常数K=
=
•
=
=
=102.5;
故答案为:102.5;
(6)锰离子在酸性条件下被氯酸根离子氧化为二氧化锰,氯酸根离子被还原为氯离子,离子方程式为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+;
故答案为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+.
故答案为:12MnO2+24H++C6H12O6=12Mn2++6CO2+18H2O;能耗低、操作更简便、转化率高;
(2)适当升高反应体系温度,及适当增大H2SO4浓度可提高氧化亚锰(MnO)浸出率;
故答案为:适当升高反应体系温度,及适当增大H2SO4浓度;
(3)浸出液含有Fe3+、Cu2+等杂质,调节溶液的pH,将 Fe3+以Fe(OH)3沉淀下来,向滤液中加入硫化钠,可以将铜离子形成硫化物沉淀下来,故滤渣1为Fe(OH)3;滤渣2为CuS;
故答案为:Fe(OH)3;CuS;
(4)滤液2主要成分为硫酸锰,加入NH4HCO3晶体生成碳酸锰、硫酸铵、二氧化碳和水,反应为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;碳酸锰高温下被氧气氧化为二氧化锰,反应为:2MnCO3+O2
| ||
故答案为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;2MnCO3+O2
| ||
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,反应MnCO3(s)+2OH-(aq)⇌Mn(OH)2(s)+CO32-(aq),平衡常数K=
| c(CO32-) |
| c2(OH-) |
| c(CO32-) |
| c2(OH-) |
| c(Mn2+) |
| c(Mn2+) |
| Ksp(MnCO3) |
| Ksp[Mn(OH)2] |
| 10-10.2 |
| 10-12.7 |
故答案为:102.5;
(6)锰离子在酸性条件下被氯酸根离子氧化为二氧化锰,氯酸根离子被还原为氯离子,离子方程式为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+;
故答案为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+.
看了软锰矿(主要成份为MnO2)可...的网友还看了以下:
为什么稀酸不和二氧化锰反应氧化性不强,为什么就不能反应按照碱性氧化物与酸反应,也应该反应那个复制答案 2020-03-30 …
实验室里用二氧化锰与浓盐酸反应来制取适量的氯气,现用100ml的浓盐酸与二氧化锰反应,生成的氯气在 2020-05-15 …
1空气 2冰水共存物 3高锰酸钾 4氧气 5水蒸气 6水银 7液氮 8自来水 混合物:纯净物:单质 2020-05-16 …
某学生称取12.25g的氯酸钾制氧气.用少量的高锰酸钾代替二氧化锰反应完毕后制得氧气4.96g加了 2020-06-14 …
浓盐酸和高锰酸钾反应制氯气浓盐酸和高锰酸钾反应,还有浓盐酸和二氧化锰反应都可以制氯气.前者不用加热 2020-06-14 …
1.白磷和溴水反应2.碘化钾和磷酸反应3.碘离子、溴酸根(过量)在酸性条件下的反应4.碘化氢和氧气 2020-07-02 …
氯化亚铜在水溶液中与二氧化锰反应a.二氧化锰作催化剂氯化亚铜发生歧化反应,生成氯化铜和铜单质.b. 2020-07-03 …
锌锰干电池的负极反应中二氧化锰反应生成什么?是三氧化二锰还是MnOOH? 2020-07-05 …
催化剂在起催化作用时,也参与化学反应过程.例如:实验室用氯酸钾和二氧化锰混合物加热制氧气时,在氯酸钾 2021-01-11 …
1.在硫酸铜、水、生石灰、碳酸钙、盐酸铁、烧碱中选择适当物质写方程化合、分解、置换、复分解各两个2. 2021-02-01 …