草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4·2H2O工艺流程如下:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+
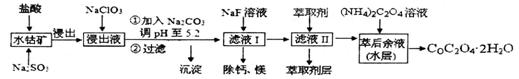 草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4·2H2O工艺流程如下:
草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4·2H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
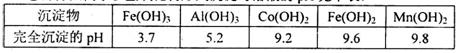
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是_______________。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为____________________________________________________________________________
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_______________________________________________________
 (4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液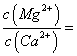 ______。
______。
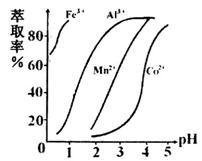
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
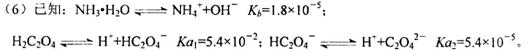 a.1 b.2 c.3 d.4
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
(7)CoC2O4·2H2O热分解质量变化过程如右图所示(其中600℃以前是隔绝空气加热, 600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是________________________________
(1)还原Fe3+、Co3+为Fe2+、Co2+(2分,还原1分,Fe3+和Co3+共1分,)
(2)ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O (2分,有错无分)
(3)加入的碳酸钠(或CO32-)与H+反应,c(H+)降低(1分),使Fe3+和Al3+(用
M3+代替)的水解平衡M3++3H2O![]() M(OH)3+3H+(1分),向右移动,而产生氢氧
M(OH)3+3H+(1分),向右移动,而产生氢氧
化物沉淀(1分)(注:水解的离子方程式任写一个就给分1分,共3分)
(4![]() )0.7(2分)[Ksp(MgF2)÷Ksp(CaF2)= 7.35×10-11÷1.05×10-10=0.7]
)0.7(2分)[Ksp(MgF2)÷Ksp(CaF2)= 7.35×10-11÷1.05×10-10=0.7]
(5)c(2分)![]()
(6)<(2分)
(7)Co3O4(2分)(写成CoO·Co2O3亦给分,但Co2O3·CoO不给分)
1.PT切圆O于T,CT为直径,D为OC上的一点,支线PD交圆O于B和A,B在线段PD上,若CD= 2020-04-12 …
水的化学键为什么有H-O,为什么不是H-O-H为什么一摩尔水有两摩尔的O-H,这两摩尔合起来还是水 2020-05-17 …
如图,在平面直角坐标系中,o为坐标原点,抛物线y等于二分之一x方加2x与x轴相交于点O,B两点顶点 2020-06-14 …
已知,Rt△ABC中,∠C=90°,AC=4,BC=3.以AC上一点O为圆心的⊙O与BC相切于点C 2020-06-15 …
如图,四边形ABCD是菱形,对角线BD上有一点O,以O为圆心,OD长为半径的圆记为O.(1)当O经 2020-06-22 …
(2014•仪征市二模)如图,AB为⊙O的直径,AC为⊙O的弦,AD平分∠BAC,交⊙O于点D,D 2020-07-21 …
如图,⊙O是△ABC的外接圆,BC为⊙O的直径,点E为△ABC的内心,连接AE并延长交⊙O于D点, 2020-07-30 …
如图,AB为O的直径,C为O上一点,AD和过点C的切线互相垂直,垂足为D,AD交O于点E(1)求证 2020-07-30 …
1.在△ABC中,如果O为外心,I为内心,且∠BOC=1100,则∠BIC=.2.点P到⊙O的最短 2020-08-01 …
尺规作图,角(锐角)OAB以O为圆心,任意长为半径用圆规画弧,分别叫OA,OB于点C、D.任意画一点 2020-11-26 …