早教吧作业答案频道 -->化学-->
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;②部
题目详情
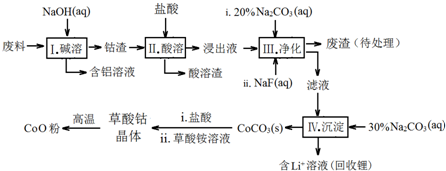
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式___.
(2)步骤Ⅱ中Co2O3与盐酸反应的离子方程式___.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应调节溶液的pH范围是___;废渣中的主要成分为___.
(4)步骤Ⅲ中NaF参与的反应对步骤Ⅳ所起的作用是___.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,[M (CoC2O4•2H2O)=183g/mol]受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是___.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式___.
(2)步骤Ⅱ中Co2O3与盐酸反应的离子方程式___.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应调节溶液的pH范围是___;废渣中的主要成分为___.
(4)步骤Ⅲ中NaF参与的反应对步骤Ⅳ所起的作用是___.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,[M (CoC2O4•2H2O)=183g/mol]受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
▼优质解答
答案和解析
(1)步骤Ⅰ中得到含铝溶液是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)氧化钴氧化盐酸溶液中氯化氢为氯气,结合原子守恒和电子守恒分析配平书写离子方程式,钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,沉淀铁离子,依据表中数据分析判断应使溶液的pH超过3.2,但不能沉淀钴离子,应使溶液的pH不超过7.15,废渣中的主要成分除了LiF外还有Fe(OH)3;
故答案为:3.2-7.15;Fe(OH)3、LiF;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)计算晶体物质的量n=
=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150~210固体质量变化=5.49g-4.41g=1.08g,说明210°C失去结晶水得到CoC2O4,210~290℃过程中是CoC2O4发生的反应,210~290℃过程中产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明不是分解反应,参加反应的还有氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=
=0.02mol;n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,依据原子守恒配平书写反应的化学方程式为3CoC2O4+2O2
Co3O4+6CO2,
故答案为:3CoC2O4+2O2
Co3O4+6CO2.
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)氧化钴氧化盐酸溶液中氯化氢为氯气,结合原子守恒和电子守恒分析配平书写离子方程式,钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,沉淀铁离子,依据表中数据分析判断应使溶液的pH超过3.2,但不能沉淀钴离子,应使溶液的pH不超过7.15,废渣中的主要成分除了LiF外还有Fe(OH)3;
故答案为:3.2-7.15;Fe(OH)3、LiF;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)计算晶体物质的量n=
| 5.49g |
| 183g/mol |
| 0.64g |
| 32g/mol |
| ||
故答案为:3CoC2O4+2O2
| ||
看了钴(Co)及其化合物在工业上有...的网友还看了以下:
例:解方程x4-7x2+12=0设x2=y,则x4=y2,∴原方程可化为:y2+7y+12=0,解 2020-04-07 …
做变速直线运动的物体在5s内通过了10m的路程,则它在前2s内通过的路程是[]A.等于4mB.大于 2020-05-14 …
在方程:3X-3=2X-3里,方程两边都加上3,得3X-3+3=2X-3+3,于是3X=2X,方程 2020-05-17 …
对于ax+b=0(a,b为常数),表述正确的是[]A.当a≠0时,方程的解是x=B.当a=0,b≠ 2020-06-11 …
下列过程中,物体的重力势能转化为动能的是()A.投篮时,篮球上升的过程B.电梯匀速上升的过程C.汽 2020-06-21 …
下列对治理黄河提出的建议中,不合理的是()A.在上游地区修建水利枢纽工程B.在中游地区植树种草,修 2020-06-24 …
如图所示,运动员在进行蹦床比赛,运动员离开蹦床向上运动到一定高度又落到蹦床上.不计空气阻力,关于运动 2020-11-24 …
李白诗句中的“长江之水天上来,奔流到海不复返”违背的水循环过程是A.陆地内循环过程B.海陆间水循环过 2020-11-26 …
如图是某工厂从工程设计B到试生产H的工序流程图,方框上方的数字为这项工序所用的天数,则从工程设计到结 2020-12-01 …
李白诗句中的“长江之水天上来,奔流到海不复返”违背的水循环过程是A.陆地内循环过程B.海陆间水循环过 2021-01-27 …