早教吧作业答案频道 -->化学-->
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;②部
题目详情
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
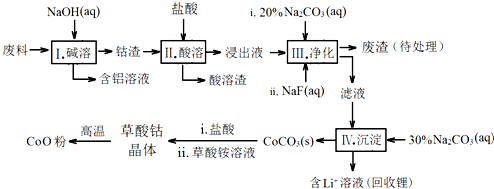
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是___.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式___
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过___.废渣中的成分有___.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是___.
(6)某锂离子电池的总反应为C+LiCoO2
LixC+Li1-xCoO2,LixC中Li的化合价为___价,该锂离子电池充电时阳极的电极反应式为___.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是___.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式___
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过___.废渣中的成分有___.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是___.
(6)某锂离子电池的总反应为C+LiCoO2
| 充电 |
| |
| 放电 |
▼优质解答
答案和解析
(1)步骤Ⅰ中铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Co2O3与盐酸反应生成Cl2,反应中钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,依据得失电子守恒可知Co2O3的系数为1,Cl-的系数为2,结合原子个数守恒,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分为LiF和Fe(OH)3;
故答案为:7.15; LiF,Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)210℃~290℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=
=0.02mol,则:
n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式计量系数之比等于转化量之比,所以该反应的方程式为:3CoC2O4+2O2
Co3O4+6CO2;
故答案为:3CoC2O4+2O2
Co3O4+6CO2;
(6)LiCoO2中锂元素化合价为+1价,则依据放电为原电池反应,锂元素化合价升高发生氧化反应分析判断,LixC中锂元素化合价为0价,是锂单质镶嵌在碳中做原电池负极,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应:LiCoO2-xe-=Li1-xCoO2 +xLi+,C为阴极得电子发生还原反应:C+xe-+xLi+=LixC,
故答案为:0,LiCoO2-xe-=Li1-xCoO2+xLi+;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Co2O3与盐酸反应生成Cl2,反应中钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,依据得失电子守恒可知Co2O3的系数为1,Cl-的系数为2,结合原子个数守恒,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分为LiF和Fe(OH)3;
故答案为:7.15; LiF,Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)210℃~290℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=
| 0.064g |
| 32g/mol |
n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式计量系数之比等于转化量之比,所以该反应的方程式为:3CoC2O4+2O2
| ||
故答案为:3CoC2O4+2O2
| ||
(6)LiCoO2中锂元素化合价为+1价,则依据放电为原电池反应,锂元素化合价升高发生氧化反应分析判断,LixC中锂元素化合价为0价,是锂单质镶嵌在碳中做原电池负极,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应:LiCoO2-xe-=Li1-xCoO2 +xLi+,C为阴极得电子发生还原反应:C+xe-+xLi+=LixC,
故答案为:0,LiCoO2-xe-=Li1-xCoO2+xLi+;
看了钴(Co)及其化合物在工业上有...的网友还看了以下:
区间上连续函数的全体的集合记作C(I),难道不是f在...区间上连续函数的全体的集合记作C(I), 2020-06-05 …
自学高等代数难吗?我只有高中文化!而且离开10年了,想学一下高数的基础东西,主要是接触的东西好多都 2020-07-25 …
物理问题我们学过电热器的电阻丝的电阻越大产热越多可是根据焦耳定律Q=I*I*R*t得到Q=[U*U* 2020-11-03 …
高等数学难不难?我是一名大一新生,报的会计学专业,我看到里面有高等数学这一科目...本人数学超烂!请 2020-11-21 …
高一化学求琦琦琦琦琦琦琦琦i去难死了在一定温度下,有A,B2个容器,A是恒容密闭容器,B是恒压密闭容 2020-11-30 …
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯 2020-12-07 …
当前,一些外国用户在接受中国品牌方面还存在一定的困难和障碍。有人认为,语言、品牌故事等文化因素难以为 2020-12-10 …
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯 2020-12-26 …
解关于x的不等式ax2-2≥2x-ax,(a≤0).题型:解答题难度:中档来源:不详解原不等式可化为 2021-01-01 …
欧姆定律公式变换看不明白P=I*U=I的平方*R=R份之U平方等变化公式看不明白 2021-01-07 …