早教吧作业答案频道 -->化学-->
钴周期表第四周期第ⅥⅡ族元素,其化合价用途广泛,如:LiCoO2做锂电池的正极材料,草酸钴可用于指示剂和催化剂制备.Ⅰ(1)LiCoO2中钴元素的化合价为.(2)工业上将废锂电池的正
题目详情
钴周期表第四周期第ⅥⅡ族元素,其化合价用途广泛,如:LiCoO2做锂电池的正极材料,草酸钴可用于指示剂和催化剂制备.
Ⅰ(1)LiCoO2中钴元素的化合价为___.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为___可用盐酸代替H2SO4和H2O2的混合液,但缺点是___.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:
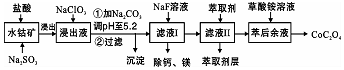
已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(3)浸出过程中加入NaClO3的目的是___.
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因___.
(5)滤液Ⅱ中加入萃取剂的作用是___.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=___.
Ⅰ(1)LiCoO2中钴元素的化合价为___.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为___可用盐酸代替H2SO4和H2O2的混合液,但缺点是___.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:

已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因___.
(5)滤液Ⅱ中加入萃取剂的作用是___.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=___.
▼优质解答
答案和解析
Ⅰ.(1)钴酸锂(LiCoO2)中Li为+1价,O为-2价,则钴元素的化合价为+3,
故答案为:+3;
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,Co元素化合价降低,则过氧化氢被氧化为氧气,同时生成水,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O,因为盐酸也具有强酸性和还原性,理论上可以代替H2SO4和H2O2,但上述反应可知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O;生成的氯气造成污染,且盐酸易挥发,浪费很大;
Ⅱ.(3)要使Fe2+沉淀的pH=9.6,Co2+沉淀的pH=9.2,如直接除掉Fe2+,溶液中的Co2+也沉淀下来,Fe3+沉淀的pH=3.7,所以加NaClO3将浸出液中Fe2+氧化为Fe3+,利于从混合液中除去,
故答案为:将Fe2+氧化为Fe3+,利于从混合液中除去;
(4)加Na2CO3调PH=5.2能使Fe3+、Al3+ 离子转化成氢氧化物沉淀,原因是:因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O⇌M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀,
故答案为:因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O⇌M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀;
(5)由工艺流程可知溶液中的锰离子还未除去,最终得到草酸钴,说明滤液中加入萃取剂的作用是除去锰离子;
故答案为:除去Mn2+;
(6)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=
=
=0.7,
故答案为:0.7.
故答案为:+3;
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,Co元素化合价降低,则过氧化氢被氧化为氧气,同时生成水,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O,因为盐酸也具有强酸性和还原性,理论上可以代替H2SO4和H2O2,但上述反应可知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O;生成的氯气造成污染,且盐酸易挥发,浪费很大;
Ⅱ.(3)要使Fe2+沉淀的pH=9.6,Co2+沉淀的pH=9.2,如直接除掉Fe2+,溶液中的Co2+也沉淀下来,Fe3+沉淀的pH=3.7,所以加NaClO3将浸出液中Fe2+氧化为Fe3+,利于从混合液中除去,
故答案为:将Fe2+氧化为Fe3+,利于从混合液中除去;
(4)加Na2CO3调PH=5.2能使Fe3+、Al3+ 离子转化成氢氧化物沉淀,原因是:因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O⇌M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀,
故答案为:因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O⇌M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀;
(5)由工艺流程可知溶液中的锰离子还未除去,最终得到草酸钴,说明滤液中加入萃取剂的作用是除去锰离子;
故答案为:除去Mn2+;
(6)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=
| Ksp(MgF2) |
| Ksp(CaF2) |
| 7.35×10-11 |
| 1.05×10-10 |
故答案为:0.7.
看了钴周期表第四周期第ⅥⅡ族元素,...的网友还看了以下:
用Fe3+和Cu2+做催化剂催化双氧水哪一个反应更快上网查的说法不一.另外那个氯化铁和硫酸铜的催化 2020-05-13 …
返回 首页 除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是返回x05x 2020-05-14 …
二氧化硫用什么催化剂生成三氧化硫用硫磺做硫酸、我是家庭制作少量的硫酸能用什么做催化剂、把你知道的都 2020-05-17 …
做液相色谱,正常时HPLC级别的.如果用GC纯度的试剂是否可以用.试剂是三氟乙醇,进口的.没有查到 2020-06-27 …
重结晶提取法思考题1.热过滤后的滤液为什么不宜摇动或用冷水、冰箱等快速冷却?2.抽滤时,能否用溶剂 2020-06-29 …
下列对有关物质检测所使用的试剂和产生现象的描述,正确的是()选项待检测的物质使用试剂呈现颜色A苹果 2020-07-05 …
(10分).已知室温下乙醛的沸点为20.8℃,且与水互溶。用HgSO4做催化剂,在75℃左右,乙炔可 2020-11-29 …
萃取程序中选用溶剂之叙述何者正确?1俩溶剂就完全互溶2不相溶3两剂需有化学反应4两剂颜色相同5两剂都 2020-12-14 …
萃取程序中选用溶剂之叙述何者正确?1俩溶剂就完全互溶2不相溶3两剂需有化学反应4两剂颜色相同5两剂都 2020-12-14 …
在题后横线上简要说明下列操作可能造成的不良后果:(1)滴管取用试剂后平放或倒置.腐蚀橡胶帽腐蚀橡胶帽 2020-12-15 …