早教吧作业答案频道 -->化学-->
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:(1)
题目详情
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:
(1)在空气中加热CoCO3可得到黑色Co3O4,写出该反应的化学方程式___.
(2)Co3O4与浓盐酸反应能生成黄绿色气体,写出该反应的离子方程式___.
(3)常温下,CoCl2溶液在碱性条件下可以得到粉红色Co(OH)2沉淀.已知当溶液中某离子的浓度≤10-5mol•L-1时,就认为该离子不存在,Ksp[Co(OH)2]=1.0×
10-15mol3•L-3.若要使0.1mol•L-1CoCl2溶液中的Co2+完全沉淀,则溶液pH的控制范围为___.
(4)Co(OH)2具有较显著的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式___.
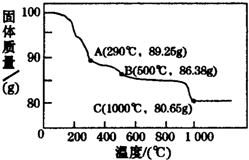
(5)Co(OH)2在空气中加热时,样品质量随温度变化的曲线如图所示,通过分析计算确定:
①1000℃时,固体的成分为___.②取800℃时的产物(其中Co的化合价为+2、+3),用480mL5mol•L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体.则该钴氧化物中n(Co2+):n(Co3+)=___.

(1)在空气中加热CoCO3可得到黑色Co3O4,写出该反应的化学方程式___.
(2)Co3O4与浓盐酸反应能生成黄绿色气体,写出该反应的离子方程式___.
(3)常温下,CoCl2溶液在碱性条件下可以得到粉红色Co(OH)2沉淀.已知当溶液中某离子的浓度≤10-5mol•L-1时,就认为该离子不存在,Ksp[Co(OH)2]=1.0×
10-15mol3•L-3.若要使0.1mol•L-1CoCl2溶液中的Co2+完全沉淀,则溶液pH的控制范围为___.
(4)Co(OH)2具有较显著的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式___.
(5)Co(OH)2在空气中加热时,样品质量随温度变化的曲线如图所示,通过分析计算确定:
①1000℃时,固体的成分为___.②取800℃时的产物(其中Co的化合价为+2、+3),用480mL5mol•L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体.则该钴氧化物中n(Co2+):n(Co3+)=___.
▼优质解答
答案和解析
(1)在空气中加热CoCO3可以和氧气反应得到黑色Co3O4,即6CoCO3+O2=2Co3O4+6CO2,故答案为:6CoCO3+O2=2Co3O4+6CO2;
(2)Co3O4与浓盐酸反应,能生成黄绿色气体氯气,同时得到还原产物氯化钴,发生反应的离子方程式为:Co3O4+8H++2Cl-═3Co2++Cl2↑+4H2O,故答案为:Co3O4+8H++2Cl-═3Co2++Cl2↑+4H2O;
(3)Co2+完全沉淀,即c(Co2+)<10-5 mol•L-1,Ksp=c(Co2+)c2(OH-),溶液中氢氧根离子浓度=
=10-5mol/L,所以c(H+)=10-9mol/L,若要使0.1mol•L-1CoCl2溶液中的Co2+完全沉淀,则溶液pH的控制范围为≥9,故答案为:≥9;
(4)Co(OH)2酸式电离电离出氢离子和=[Co(OH)4]2-,电离方程式为:Co(OH)2+2H2O[Co(OH)4]2-+2H+,故答案为:Co(OH)2+2H2O[Co(OH)4]2-+2H+;
(5)①由于Co有+2、+3价,原始为Co(OH)2,相对分子质量为93,得到固体的质量是x,则
=
,解得x=75,所以得到的固体成分为为CoO,故答案为:CoO.
②由电子守恒:n(Co3+)=2 n(Cl2)=2×
=0.4 mol,由电荷守恒:n(Co原子)总=n(Co2+)溶液=
n(Cl-)=
×( 0.48L×5mol/L-2×
)=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,则钴氧化物中n(Co2+):n(Co3+)=0.64:0.4=3:2;
故答案为:3:2.
(2)Co3O4与浓盐酸反应,能生成黄绿色气体氯气,同时得到还原产物氯化钴,发生反应的离子方程式为:Co3O4+8H++2Cl-═3Co2++Cl2↑+4H2O,故答案为:Co3O4+8H++2Cl-═3Co2++Cl2↑+4H2O;
(3)Co2+完全沉淀,即c(Co2+)<10-5 mol•L-1,Ksp=c(Co2+)c2(OH-),溶液中氢氧根离子浓度=
|
(4)Co(OH)2酸式电离电离出氢离子和=[Co(OH)4]2-,电离方程式为:Co(OH)2+2H2O[Co(OH)4]2-+2H+,故答案为:Co(OH)2+2H2O[Co(OH)4]2-+2H+;
(5)①由于Co有+2、+3价,原始为Co(OH)2,相对分子质量为93,得到固体的质量是x,则
| x |
| 93 |
| 80.65 |
| 100 |
②由电子守恒:n(Co3+)=2 n(Cl2)=2×
| 4.48L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
| 4.48L |
| 22.4L/mol |
故答案为:3:2.
看了钴(Co)及其化合物在磁性材料...的网友还看了以下:
12分)立方氮化硼(cBN)是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,但耐热性、化学 2020-07-05 …
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单 2020-11-01 …
翡翠的主要成分是硬玉[化学式为NaAl(Si2O6)].下列有关硬玉的说法不正确的是()A、硬玉属于 2020-12-03 …
化学与生产、生活和社会密切相关。下列说法不正确的是A.漂白粉长期暴露在空气中会变质失效B.雾霾天车灯 2020-12-05 …
化学与生产、生活和社会密切相关.下列说法不正确的是()A.漂白粉长期暴露在空气中会变质失效B.雾霾天 2020-12-05 …
氮化硼(BN)是新型无机非金属材料,溶点3000℃,可以作润滑剂、高级耐火材料和超硬材料.某兴趣小组 2020-12-07 …
下列叙述不正确的是[]A.唾液中的淀粉酶是一种生物催化剂B.合成纤维、塑料、合金等都属于有机合成材料 2021-01-01 …
制造货币,应该根据下列哪些性质而选材()A.从化学性质来看,金属材料化学性质应稳定B.从物理性质来看 2021-01-01 …
制造货币,应该根据下列哪些性质而选材A.从化学性质来看,金属材料化学性质应稳定B.从物理性质来看,金 2021-01-01 …
下列有关水和溶液的说法正确的是()A.自然界中的水都属于化合物,溶液都属于混合物B.硬水和软水都属于 2021-01-10 …