早教吧作业答案频道 -->化学-->
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取钴的氧化物的流程如图1:(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是.(2)步骤Ⅱ需要加热搅拌,相
题目详情
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取钴的氧化物的流程如图1:
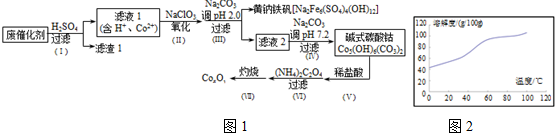
(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是___.
(2)步骤Ⅱ需要加热搅拌,相应的离子方程式为___.
(3)步骤Ⅲ中的反应为2Na++6Fe3++4SO42-+12H2O═Na2Fe6(SO4)4(OH)12+12H+.过滤后母液的pH=2,.0,c(Na+)=a mol•L-1,c(Fe3+)=b mol•L-1,c(SO42-)=d mol•L-1,该反应的平衡常数K=___(用含a、b、d 的代数式表示).
(4)完成步骤Ⅳ中反应的离子方程式:
□___+□CO32-+□H2O═Co5(OH)6(CO3)2↓+□___
(5)已知CoCl2的溶解度曲线如图2所示.步骤Ⅴ向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌,待固体溶解后需趁热过滤.
①边加热边搅拌的原因是___;
②趁热过滤的原因是___.

(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是___.
(2)步骤Ⅱ需要加热搅拌,相应的离子方程式为___.
(3)步骤Ⅲ中的反应为2Na++6Fe3++4SO42-+12H2O═Na2Fe6(SO4)4(OH)12+12H+.过滤后母液的pH=2,.0,c(Na+)=a mol•L-1,c(Fe3+)=b mol•L-1,c(SO42-)=d mol•L-1,该反应的平衡常数K=___(用含a、b、d 的代数式表示).
(4)完成步骤Ⅳ中反应的离子方程式:
□___+□CO32-+□H2O═Co5(OH)6(CO3)2↓+□___
(5)已知CoCl2的溶解度曲线如图2所示.步骤Ⅴ向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌,待固体溶解后需趁热过滤.
①边加热边搅拌的原因是___;
②趁热过滤的原因是___.
▼优质解答
答案和解析
(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,能够将滤渣中的钴元素的浸出率,所以其目的是提高钴元素的总浸出率,
故答案为:提高钴元素的总浸出率;
(2)亚铁离子被氯酸根离子氧化成铁离子,1molr的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O,
故答案为:6Fe2++6H++ClO3-
6Fe3++Cl-+3H2O;
(3)除去杂质的化学方程式可表示为:2Na++6Fe3++4SO42-+12H2O═Na2Fe6(SO4)4(OH)12+12H+,过滤后母液的pH=2.0,c(Na+)=a mol•L-1,c(Fe3+)=b mol•L-1,c(SO42-)=d mol•L-1,氢离子浓度为10-2,依据K的表达式写出K=
=
,
故答案为:
;
(4)Co2+与CO32-发生双水解,离子方程式为:5Co2++5CO32-+3H2O=Co5(OH)6(CO3)2↓+3CO2↑,
故答案为:5Co2++5CO32-+3H2O=Co5(OH)6(CO3)2↓+3CO2↑;
(5)①边加热边搅拌,能加快固体与溶剂的接触速度,加快固体溶解速率,
故答案为:加快固体溶解速率;
②CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低CoCl2晶体析出,
故答案为:防止因温度降低,CoCl2晶体析出.
故答案为:提高钴元素的总浸出率;
(2)亚铁离子被氯酸根离子氧化成铁离子,1molr的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O,
故答案为:6Fe2++6H++ClO3-
| ||
(3)除去杂质的化学方程式可表示为:2Na++6Fe3++4SO42-+12H2O═Na2Fe6(SO4)4(OH)12+12H+,过滤后母液的pH=2.0,c(Na+)=a mol•L-1,c(Fe3+)=b mol•L-1,c(SO42-)=d mol•L-1,氢离子浓度为10-2,依据K的表达式写出K=
| C2(H+) |
| C2(Na+)×C6(Fe3+)×C4(SO42-) |
| (10-2)12 |
| a2×b6×d4 |
故答案为:
| (10-2)12 |
| a2×b6×d4 |
(4)Co2+与CO32-发生双水解,离子方程式为:5Co2++5CO32-+3H2O=Co5(OH)6(CO3)2↓+3CO2↑,
故答案为:5Co2++5CO32-+3H2O=Co5(OH)6(CO3)2↓+3CO2↑;
(5)①边加热边搅拌,能加快固体与溶剂的接触速度,加快固体溶解速率,
故答案为:加快固体溶解速率;
②CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低CoCl2晶体析出,
故答案为:防止因温度降低,CoCl2晶体析出.
看了以含钴废催化剂(主要成分为Co...的网友还看了以下:
人工降雨催化剂总投放量最少,但效能最高的主要催化剂是()A盐粒等吸湿剂B温度很低能使水汽凝结的干冰 2020-04-26 …
土豆中淀粉的分解所需的催化剂多次烧煮的土豆会慢慢变甜,是因为淀粉被分解成了麦芽糖吗?但这反应是要催 2020-05-13 …
关于一个反应的催化剂草木灰、炭粉、氨气加热发生反应需要催化剂吗?需要什么催化剂? 2020-07-10 …
下列关于催化剂的说法正确的是()A.催化剂一定加快反应速度B.在反应前后,催化剂的化学性质和质量不 2020-07-20 …
镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量 2020-07-24 …
下列关于催化剂的说法正确的是()A.化学反应前后,催化剂的质量和化学性质都不变B.催化剂一定是二氧化 2020-11-20 …
下列关于催化剂的说法中,正确的是()A.化学反应前后,催化剂的质量和性质不变B.任何化学反应都需要催 2020-11-20 …
热化学方程式的反应条件在25°C101kPa的条件下省略不写,老师说这是反应的环境条件,那么当反应中 2020-12-01 …
翻译:如果合同要求以信用证为结算方式,则我们要催如果合同要求以信用证为结算方式,则我们要催进口方及时 2020-12-07 …
煮沸有气泡的水搅拌后为什么会没有气泡没有响声?我发现煮沸腾了的水,只要用筷子或者用其他的物体搅拌时, 2020-12-14 …