早教吧作业答案频道 -->化学-->
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度(20℃)AgCl:1.5×10-4gAg2SO4:0.796g(1)甲同学的实验如表:序号操作现象实验Ⅰ
题目详情
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如表:
注:经检验黑色固体为Ag
①白色沉淀的化学式是___.
②甲同学得出Ag+氧化了Fe2+的依据是___.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.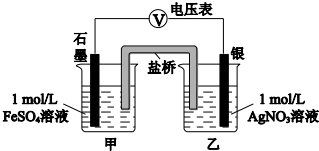
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a 中甲烧杯里的电极反应式是___.
②b中电压表指针逆向偏移后,银为___ 极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是___.
(3)为进一步验证乙同学的结论,丙同学又进行了如表实验:
①实验Ⅲ___(填“能”或“不能”)证明Fe3+氧化了Ag,理由是___.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:___.
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如表:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3 溶液加入到1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN 溶液 | 溶液变红 |
①白色沉淀的化学式是___.
②甲同学得出Ag+氧化了Fe2+的依据是___.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.

b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a 中甲烧杯里的电极反应式是___.
②b中电压表指针逆向偏移后,银为___ 极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是___.
(3)为进一步验证乙同学的结论,丙同学又进行了如表实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:___.
▼优质解答
答案和解析
(1)①AgNO3 中的银离子与硫酸根离子结合生成硫酸银沉淀,所以生成的白色沉淀为Ag2SO4;
故答案为:Ag2SO4;
②AgNO3 溶液加入到FeSO4溶液中有Ag生成,说明银离子被亚铁离子还原,亚铁离子被氧化为铁离子,铁离子遇到KSCN溶液会生成红色溶液,所以甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag )生成,加入KSCN 溶液后变红;
故答案为:有黑色固体(Ag )生成,加入KSCN 溶液后变红;
(2)①实验过程中电压表指针偏移,偏移的方向表明:电子由石墨经导线流向银,依据原电池原理可知银做原电池正极,石墨做原电池负极,负极是甲池溶液中亚铁离子失电子发生氧化反应生成铁离子,a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+;
故答案为:Fe2+-e-=Fe3+;
②随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,依据电子流向可知乙池中银做原电池负极,发生的反应为铁离子氧化为银生成亚铁离子;
故答案为:负;
③由实验现象得出,Ag+和Fe2+反应生成铁离子和金属银,反应的离子方程式是Fe2++Ag+⇌Fe3++Ag;
故答案为:Fe2++Ag+⇌Fe3++Ag;
(3)①将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中银镜消失,说明银杯氧化,可能是溶液中铁离子的氧化性,也可能是铁离子水解显酸性的溶液中,硝酸根离子在酸溶液中具有了强氧化性,稀硝酸溶解银,所以实验Ⅲ不能证明Fe3+氧化了Ag,
故答案为:不能;因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag;
②将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中银镜减少,未消失说明部分溶解,将2mL 2mol/L FeCl3溶液加入有银镜的试管中银镜消失,说明银溶解完全,依据上述现象可知,溶液中存在平衡:Fe3++Ag⇌Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大,
故答案为:溶液中存在平衡:Fe3++Ag⇌Fe2++Ag+,且 AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
故答案为:Ag2SO4;
②AgNO3 溶液加入到FeSO4溶液中有Ag生成,说明银离子被亚铁离子还原,亚铁离子被氧化为铁离子,铁离子遇到KSCN溶液会生成红色溶液,所以甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag )生成,加入KSCN 溶液后变红;
故答案为:有黑色固体(Ag )生成,加入KSCN 溶液后变红;
(2)①实验过程中电压表指针偏移,偏移的方向表明:电子由石墨经导线流向银,依据原电池原理可知银做原电池正极,石墨做原电池负极,负极是甲池溶液中亚铁离子失电子发生氧化反应生成铁离子,a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+;
故答案为:Fe2+-e-=Fe3+;
②随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,依据电子流向可知乙池中银做原电池负极,发生的反应为铁离子氧化为银生成亚铁离子;
故答案为:负;
③由实验现象得出,Ag+和Fe2+反应生成铁离子和金属银,反应的离子方程式是Fe2++Ag+⇌Fe3++Ag;
故答案为:Fe2++Ag+⇌Fe3++Ag;
(3)①将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中银镜消失,说明银杯氧化,可能是溶液中铁离子的氧化性,也可能是铁离子水解显酸性的溶液中,硝酸根离子在酸溶液中具有了强氧化性,稀硝酸溶解银,所以实验Ⅲ不能证明Fe3+氧化了Ag,
故答案为:不能;因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag;
②将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中银镜减少,未消失说明部分溶解,将2mL 2mol/L FeCl3溶液加入有银镜的试管中银镜消失,说明银溶解完全,依据上述现象可知,溶液中存在平衡:Fe3++Ag⇌Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大,
故答案为:溶液中存在平衡:Fe3++Ag⇌Fe2++Ag+,且 AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
看了为探究Ag+与Fe3+氧化性的...的网友还看了以下:
小花学会了葱炒鸡蛋,这项工作需要一下几道工序:1.敲蛋1分钟2.搅蛋2分钟3.切葱2分钟4.烧热锅 2020-05-19 …
星期日,小磊学做西红柿炒鸡蛋,要7道工序,前后共花了13分钟,而妈妈说只花10分钟就可以了.以下是 2020-06-27 …
阅读下面文言文,按要求答题。设为庠序学校以教之。庠者,养也;校者,教也;序者,射也。夏日校,殷日序 2020-07-02 …
如图是小明学习压强和浮力时所做的两个实验:(1)图甲的覆杯实验证明了的存在;(2)图乙是验证阿基米 2020-07-04 …
阅读下列《孟子》选段,回答后面问题。“设为庠序学校以教之;庠者养也,校者教也,序者射也;夏曰校,殷 2020-07-28 …
小花学会了葱炒鸡蛋,这项工作需要一下几道工序:1.敲蛋1分钟2.搅蛋2分钟3.切葱2分钟.小花学会了 2020-11-11 …
语文必修三琵琶行(并序)导学案上的问题20财富等着你~问:1、诗歌通过叙事塑造了哪几个人物形象,有何 2020-11-28 …
阅读下列《孟子》选段,回答后面问题(6分)“设为庠序学校以教之;庠者养也,校者教也,序者射也;夏曰校 2020-12-05 …
九年级化学课学完后,实验学校化学兴趣小组学生对“金属活动性顺序”从内容、规律以及应用等方面进行了总结 2021-01-23 …
九年级化学课学完后,实验学校化学兴趣小组学生对“金属活动性顺序”从内容、规律以及应用等方面进行了总结 2021-01-23 …