早教吧作业答案频道 -->化学-->
为了测定含氰废水中CN-的含量,某化学小组利用如图装置进行实验.关闭活塞a,将100ml含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应,打开活塞b,滴入稀硫酸溶液,然后关闭活塞
题目详情
为了测定含氰废水中CN-的含量,某化学小组利用如图装置进行实验.关闭活塞a,将100ml含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应,打开活塞b,滴入稀硫酸溶液,然后关闭活塞b.
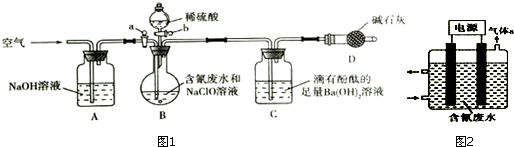
已知装置B中发生的主要反应为:CN-+ClO-=CNO-+Cl-
2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O
副反应为:Cl-+ClO-+2H+=Cl2↑+H2O
(1)装置D的作用是___.
(2)反应过程中,装置C中的实验现象为___.
(3)待装置B中反应结束后,打开活塞a,缓慢通入一段时间的空气,目的是___.
(4)反应结束后,装置C中生成39.4mg沉淀,则废水中C(CN-)=___mol.L-1.
(5)对上述实验装置进行合理改进,可通过直接测量装置C反应前后的质量变化,测定废水中CN-
的含量.设计合理实验方案___.
仪器自选.供选择的试剂:浓硫酸、NaOH溶液、饱和食盐水、饱和NaHCO3溶液、CCl4.
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.
①气体a的化学式为___.
②阳极的电极反应式为___.

已知装置B中发生的主要反应为:CN-+ClO-=CNO-+Cl-
2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O
副反应为:Cl-+ClO-+2H+=Cl2↑+H2O
(1)装置D的作用是___.
(2)反应过程中,装置C中的实验现象为___.
(3)待装置B中反应结束后,打开活塞a,缓慢通入一段时间的空气,目的是___.
(4)反应结束后,装置C中生成39.4mg沉淀,则废水中C(CN-)=___mol.L-1.
(5)对上述实验装置进行合理改进,可通过直接测量装置C反应前后的质量变化,测定废水中CN-
的含量.设计合理实验方案___.
仪器自选.供选择的试剂:浓硫酸、NaOH溶液、饱和食盐水、饱和NaHCO3溶液、CCl4.
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.
①气体a的化学式为___.
②阳极的电极反应式为___.
▼优质解答
答案和解析
(1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰,
故答案为:防止空气中的CO2和水蒸气进入C装置;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去,
故答案为:有白色沉淀生成,溶液的红色逐渐褪色;
(3)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置C并被Ba(OH)2完全吸收,以减少实验误差,
故答案为:将反应产生的CO2全部排入C装置并被Ba(OH)2完全吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O得到,装置C中生成39.4mg沉淀为BaCO3↓物质的量=
=2×10-4mol
CN-+~CNO-~CO2~BaCO3↓
1 1
c(CN-)=
=0.002mol/L,
故答案为:0.002;
(5)通过直接测量装置C反应前后的质量变化,实验中应排除水蒸气、氯气和空气中二氧化碳的干扰,需要除去氯气的洗气装置和对二氧化碳气体干燥的干燥装置,在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶,
故答案为:在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶;
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.变化过程是在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,阴极上是氢离子得到电子生成氢气;
①分析可知气体a是阴极上氢离子得到电子生成的氢气,
故答案为:H2;
②在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,电极反应为:2CN-+4H2O-2e-=C2O42-+2NH4+,
故答案为:2CN-+4H2O-2e-=C2O42-+2NH4+.
故答案为:防止空气中的CO2和水蒸气进入C装置;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去,
故答案为:有白色沉淀生成,溶液的红色逐渐褪色;
(3)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置C并被Ba(OH)2完全吸收,以减少实验误差,
故答案为:将反应产生的CO2全部排入C装置并被Ba(OH)2完全吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O得到,装置C中生成39.4mg沉淀为BaCO3↓物质的量=
| 39.4×10-3g |
| 197g/mol |
CN-+~CNO-~CO2~BaCO3↓
1 1
c(CN-)=
| 2×10-4mol |
| 0.1L |
故答案为:0.002;
(5)通过直接测量装置C反应前后的质量变化,实验中应排除水蒸气、氯气和空气中二氧化碳的干扰,需要除去氯气的洗气装置和对二氧化碳气体干燥的干燥装置,在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶,
故答案为:在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶;
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.变化过程是在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,阴极上是氢离子得到电子生成氢气;
①分析可知气体a是阴极上氢离子得到电子生成的氢气,
故答案为:H2;
②在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,电极反应为:2CN-+4H2O-2e-=C2O42-+2NH4+,
故答案为:2CN-+4H2O-2e-=C2O42-+2NH4+.
看了为了测定含氰废水中CN-的含量...的网友还看了以下:
新鲜出炉的数学疑难杂症快来看看啊.已知函数f(x)=1/2mx2-2x+1+ln(x+1)(m≥1 2020-05-23 …
A战栗lì恶劣liè姗姗shān来迟B泅qiú水阴霾lí毛骨悚sǒng然C厄è运吞噬shì海市蜃s 2020-06-23 …
下列各组词语中注音有误的一组是()A颤栗lì履lǚ践姗姗shān来迟怏怏yàng不乐B辜gū负阴霾 2020-06-26 …
基础闯关全练水滴石穿全面过关?答案P1291.下列加点字的注音有误的一项是()A.拽出(zhuài 2020-06-28 …
基础闯关全练水滴石穿全面过关?答案P1291.下列加点字的注音有误的一项是()A.拽出(zhuài 2020-07-14 …
下列加点字的读音全都正确的一组是()A.拎包(līn)档期(dǎnɡ)春风骀荡(dài)戛然而止( 2020-07-23 …
怎么计算二阶微分方程(mathematrica)我想用mathematica5来书写,但是我又不知 2020-07-31 …
请高手将下列通达信公式改为选股公式,要求选出“长期在100”。短期:100*(C-LLV(L,5)) 2020-11-06 …
下列词语中加点的字,读音错误最多的一组是()A.伯(bó)仲逡(qūn)巡喟(wèi)然潦(lǎo) 2020-11-11 …
下列词语中的字,读音错误最多的一组是A.伯(bó)仲逡(qūn)巡喟(wèi)然潦(lǎo)缩B.霰 2020-11-11 …