早教吧作业答案频道 -->化学-->
硫-碘循环分解水制氢主要涉及下列反应:ⅠSO2+2H2O+I2═H2SO4+2HIⅡ2HI⇌H2+I2Ⅲ2H2SO4═2SO2+O2+2H2O(1)分析上述反应,下列判断正确的是.a.反应Ⅲ易在常温下进行b.反应Ⅰ中SO2氧化性比HI
题目详情
硫-碘循环分解水制氢主要涉及下列反应:
ⅠSO2+2H2O+I2═H2SO4+2HI
Ⅱ2HI⇌H2+I2
Ⅲ2H2SO4═2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是___.
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1mol O2的同时产生1mol H2
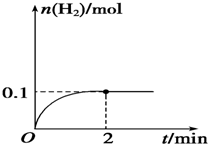
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
0~2min内的平均反应速率v(HI)=___.该温度下,H2(g)+I2(g)⇌2HI(g)的平衡常数K=___.
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的___,产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池.
已知2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为___.
ⅠSO2+2H2O+I2═H2SO4+2HI
Ⅱ2HI⇌H2+I2
Ⅲ2H2SO4═2SO2+O2+2H2O

(1)分析上述反应,下列判断正确的是___.
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
0~2min内的平均反应速率v(HI)=___.该温度下,H2(g)+I2(g)⇌2HI(g)的平衡常数K=___.
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的___,产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池.
已知2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为___.
▼优质解答
答案和解析
(1)a.硫酸常温下温度,不易分解,故a错误;
b.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故b错误;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故选:c,
故答案为:c;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
=0.1mol/L,用氢气表示的化学反应速率为
=0.05mol/(L.min),
由反应中的化学计量数可知v(HI)=0.05mol/(L.min)×2=0.1mol/(L.min);
根据方程式计算平衡浓度,c(H2)=0.1mol/L,c(I2)=0.1mol/L,c(HI)=0.8mol/L,写出平衡常数表达式计算:K=
=
=
,则该温度下,H2(g)+I2(g)⇌2HI(g)的平衡常数K=64;
故答案为:0.1mol•L-1•min-1;64;
(3)实验室用Zn和稀硫酸制取H2,反应过程中氢离子浓度减小,反应时溶液中水的电离平衡正向进行,若加入少量下列试剂中生成氢气反应速率增大的是;
a.加入NaNO3 溶液相当于稀释溶液浓度减小,反应速率减小,故a不符合;
b.加入CuSO4 溶液,和锌反应生成铜,铜和锌在稀硫酸溶液中形成原电池反应,生成氢气速率增大,故b符合;
c.加入Na2SO4溶液相当于稀释溶液浓度减小,反应速率减小,故c不符合;
d.加入NaHSO3 溶液会消耗硫酸,生成氢气的反应速率减小,故d不符合;
故答案为:向右;b;
(4)生成1mol液态水,理论上放出的能量为
=286KJ,电池的能量转化率=
×100%=
×100%=80%,
故答案为:80%.
b.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故b错误;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故选:c,
故答案为:c;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
| 0.1mol |
| 1L |
| 0.1mol/L |
| 2min |
由反应中的化学计量数可知v(HI)=0.05mol/(L.min)×2=0.1mol/(L.min);
根据方程式计算平衡浓度,c(H2)=0.1mol/L,c(I2)=0.1mol/L,c(HI)=0.8mol/L,写出平衡常数表达式计算:K=
| c(H2)c(I2) |
| c2(HI) |
| 0.1×0.1 |
| 0.82 |
| 1 |
| 64 |
故答案为:0.1mol•L-1•min-1;64;
(3)实验室用Zn和稀硫酸制取H2,反应过程中氢离子浓度减小,反应时溶液中水的电离平衡正向进行,若加入少量下列试剂中生成氢气反应速率增大的是;
a.加入NaNO3 溶液相当于稀释溶液浓度减小,反应速率减小,故a不符合;
b.加入CuSO4 溶液,和锌反应生成铜,铜和锌在稀硫酸溶液中形成原电池反应,生成氢气速率增大,故b符合;
c.加入Na2SO4溶液相当于稀释溶液浓度减小,反应速率减小,故c不符合;
d.加入NaHSO3 溶液会消耗硫酸,生成氢气的反应速率减小,故d不符合;
故答案为:向右;b;
(4)生成1mol液态水,理论上放出的能量为
| 572KJ |
| 2 |
| 实际生成量 |
| 理论生成量 |
| 228..8KJ |
| 286KJ |
故答案为:80%.
看了硫-碘循环分解水制氢主要涉及下...的网友还看了以下:
s=(a+b)h/2变成h的公式梯形的面积公式S=(a+b)h/2,其中s表示梯形面积,a表示梯形 2020-05-13 …
初一数学,一元一次方程在梯形面积公式S=1/2(a+b)h中,(1)已知S=30,a=6,h=4, 2020-05-13 …
将梯形的面积公式S=(a+b)h/2形成已知S,a,b,h的形式,若a:b:s=2:3:4,求h的 2020-05-13 …
2、一个鱼塘的形状呈梯形面积759平方米,上底长21米,下底长45米,如果要在两条底之间架设一座距 2020-05-13 …
下列粒子中,质子数和电子数都跟HS-相同的是A、K^+B、S^2+C、Cl^-D、Ar 2020-05-24 …
如图所示,质量为m的物体P放在光滑的倾角为q的直角劈上,同时用力F向右推劈,使P与劈保持相对静止, 2020-06-28 …
若a,b,S满足3根号a+5根号b=7,S=2根号a--3根号b,求S的最大值和最小值? 2020-07-21 …
填空选填:1.A:Whoisknockingatthedoor?B:It's.2.A:Whotea 2020-08-03 …
职中数学题,关于集合.@@急!1)已知集合A={m,a,t,h,s},B={e,n,g,l,i,s, 2020-11-10 …
梯形的面积公式是S=(a+b)h除以2,用字表示石下列图形的面积当b=0时,s=()当a=b时,s= 2020-12-24 …