早教吧作业答案频道 -->化学-->
食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的.已知:氧化性:IO3->Fe3+>I2还原性:S2O32->I-反应式:3I2+6OH-═5I-+IO3-
题目详情
食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的.
已知:氧化性:IO3->Fe3+>I2还原性:S2O32->I-
反应式:3I2+6OH-═5I-+IO3-+3H2O,KI+I2⇌KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+).用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色.
①该红色物质是___ (用化学式表示);CCl4中显示紫红色的物质是___(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为___;
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境中KI与氧气反应的化学方程式:___.
将I2溶于KI溶液,在低温条件下,可制得KI3・H2O.该物质作为食盐加碘剂是否合适?
___ (填“是”或“否”),并说明理由:___.
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是___.
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+:___.
已知:氧化性:IO3->Fe3+>I2还原性:S2O32->I-
反应式:3I2+6OH-═5I-+IO3-+3H2O,KI+I2⇌KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+).用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色.
①该红色物质是___ (用化学式表示);CCl4中显示紫红色的物质是___(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为___;
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境中KI与氧气反应的化学方程式:___.
将I2溶于KI溶液,在低温条件下,可制得KI3・H2O.该物质作为食盐加碘剂是否合适?
___ (填“是”或“否”),并说明理由:___.
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是___.
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+:___.
▼优质解答
答案和解析
(1)①根据实验现象判断第一份溶液为红色,说明溶液中含有铁离子与KSCN反应生成Fe(SCN)3,所以红色物质是Fe(SCN)3,第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色,说明紫色物质是碘单质,I2的电子式为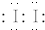 ,
,
故答案为:Fe(SCN)3;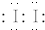 ;
;
②食盐中的碘酸根离子与碘离子在酸性条件下发生氧化还原反应生成单质碘,或者是铁离子与碘离子发生氧化还原反应生成了单质碘,离子方程式为IO3-+5I-+6H+=3I2+3H2O或2Fe3++2 I-=I2+2Fe2+,
故答案为:IO3-+5I-+6H+═3I2+3H2O或2Fe3++2I-═I2+2Fe2+;
(2)潮湿环境中KI与氧气发生氧化还原反应生成单质碘,碘易升华,引起碘的损失,反应的化学方程式为4KI+O2+2H2O=2I2+4KOH;用KI3・H2O作加碘试剂不合适,因为KI3・H2O是在低温下制取的,受热分解产生KI和碘单质,且KI易被氧化生成碘,碘易升华,
故答案为:4KI+O2+2H2O═2I2+4KOH;否;KI3在受热或潮湿条件下产生I2和KI,KI易被氧化生成碘,碘易升华;
(3)提高加碘盐的稳定性主要是防止I-被氧化,所以应选择还原性的试剂.A中的S元素的化合价是+2价,先于I-被氧化,正确;B不能作还原剂,错误;C中的碳酸根离子与盐中的铁离子反应生成沉淀,防止铁离子氧化碘离子,正确;D、亚硝酸钠是有毒物质,错误,
故答案为:AC;
(4)已经说明无铁离子,所以直接加入氧化性物质,再加入KSCN溶液若溶液变红则证明原物质中含有亚铁离子,具体操作如下:取足量该碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、过氧化氢等),再滴加KSCN溶液,若溶液变血红色,则该加碘盐中存在Fe2+,
故答案为:取足量该碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、过氧化氢等),再滴加KSCN溶液,若溶液变血红色,则该加碘盐中存在Fe2+.
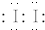 ,
,故答案为:Fe(SCN)3;
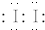 ;
;②食盐中的碘酸根离子与碘离子在酸性条件下发生氧化还原反应生成单质碘,或者是铁离子与碘离子发生氧化还原反应生成了单质碘,离子方程式为IO3-+5I-+6H+=3I2+3H2O或2Fe3++2 I-=I2+2Fe2+,
故答案为:IO3-+5I-+6H+═3I2+3H2O或2Fe3++2I-═I2+2Fe2+;
(2)潮湿环境中KI与氧气发生氧化还原反应生成单质碘,碘易升华,引起碘的损失,反应的化学方程式为4KI+O2+2H2O=2I2+4KOH;用KI3・H2O作加碘试剂不合适,因为KI3・H2O是在低温下制取的,受热分解产生KI和碘单质,且KI易被氧化生成碘,碘易升华,
故答案为:4KI+O2+2H2O═2I2+4KOH;否;KI3在受热或潮湿条件下产生I2和KI,KI易被氧化生成碘,碘易升华;
(3)提高加碘盐的稳定性主要是防止I-被氧化,所以应选择还原性的试剂.A中的S元素的化合价是+2价,先于I-被氧化,正确;B不能作还原剂,错误;C中的碳酸根离子与盐中的铁离子反应生成沉淀,防止铁离子氧化碘离子,正确;D、亚硝酸钠是有毒物质,错误,
故答案为:AC;
(4)已经说明无铁离子,所以直接加入氧化性物质,再加入KSCN溶液若溶液变红则证明原物质中含有亚铁离子,具体操作如下:取足量该碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、过氧化氢等),再滴加KSCN溶液,若溶液变血红色,则该加碘盐中存在Fe2+,
故答案为:取足量该碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、过氧化氢等),再滴加KSCN溶液,若溶液变血红色,则该加碘盐中存在Fe2+.
看了食盐中含有一定量的镁、铁等物质...的网友还看了以下:
.某品牌太阳能热水器,在晴天能接收到的太阳能平均辐射强度为R=300J/(m²·s),它表示每一平 2020-05-17 …
为什么光子能被黑洞吸引光子是没有质量的,为什么它能被黑洞的引力捕获呢?因为光子没有质量,所以黑洞不 2020-06-09 …
植物的光合作用是由于太阳的光热引起的吗? 2020-06-14 …
关于试管预热的问题加热试管,要先预热,然后再对准试管中的药品集中加热,以免受热不均,引起试管炸.预 2020-06-25 …
有一电热水器,质量为20kg,装满水后的总质量为70kg,如图是电热水器安装的尺寸及其受力示意图, 2020-07-05 …
如图所示,简易太阳能热水器受光面积1.2m2,内装80kg水,太阳每分钟辐射到1m2面积上的热量是 2020-07-18 …
下列反应可以在烃分子中引入卤原子的是()A.苯和溴水共热B.光照甲苯与溴的蒸气C.溴乙烷与NaOH 2020-07-29 …
某型号简易太阳能热水器受光面积为1.5m2,内装60kg水,太阳能的辐射热是7×10的4次幂J/m2 2020-11-05 …
用磁铁吸引光滑水平桌面上的铁钉,铁钉受到吸引而没有与磁铁接触,处于静止状态,如图所示.则磁铁对铁钉作 2020-11-20 …
太阳能热水器是把太阳能转化为内能的设备之一.某品牌太阳能热水器每平方米面积上每分钟平均接收3.5×1 2020-12-07 …