早教吧作业答案频道 -->化学-->
硫-碘循环分解水制氢主要涉及下列反应:ⅠSO2+2H2O+I2=H2SO4+2HIⅡ2HI⇌H2+I2(g)Ⅲ2H2SO4=2SO2+O2+2H2O(1)分析上述反应,下列判断正确的是.A.反应Ⅲ易在常温下进行B.反应Ⅰ中SO2氧化性比HI
题目详情
硫-碘循环分解水制氢主要涉及下列反应:
ⅠSO2+2H2O+I2=H2SO4+2HI
Ⅱ2HI⇌H2+I2(g)
Ⅲ2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是___.
A.反应Ⅲ易在常温下进行
B.反应Ⅰ中SO2氧化性比HI强
C.循环过程需补充H2O
D.循环过程产生1molO2的同时产生1molH2
(2)在一定条件下,体积不变的密闭容器中,能说明反应Ⅱ达到化学平衡状态的是___.
A.混合气体的颜色不再变化
B.混合气体的密度不再改变
C.反应混合物中各组分物质的浓度相等
D.H2、HI、I2三种物质的反应速率之比为1:2:1
E.容器中气体压强不变
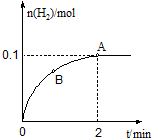
(3)一定温度下,向1L密闭容器中加入1molHI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
①0~2min内的平均反应速率v(HI)=___.
②下列关于化学反应速率的说法正确的是___.
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率常用单位时间内任何一种反应物物质的量的减小或生成物物质的量的增加来表示
C.在一定条件下,可逆反应达到化学平衡状态时,正、逆反应的速率不再改变
D.增大反应物的浓度、降低反应的温度都能增大反应速率
③A点的逆反应速率v逆(H2)___B点的正反应速率v正(H2)(填“大于”“小于”或“等于”).
ⅠSO2+2H2O+I2=H2SO4+2HI
Ⅱ2HI⇌H2+I2(g)
Ⅲ2H2SO4=2SO2+O2+2H2O

(1)分析上述反应,下列判断正确的是___.
A.反应Ⅲ易在常温下进行
B.反应Ⅰ中SO2氧化性比HI强
C.循环过程需补充H2O
D.循环过程产生1molO2的同时产生1molH2
(2)在一定条件下,体积不变的密闭容器中,能说明反应Ⅱ达到化学平衡状态的是___.
A.混合气体的颜色不再变化
B.混合气体的密度不再改变
C.反应混合物中各组分物质的浓度相等
D.H2、HI、I2三种物质的反应速率之比为1:2:1
E.容器中气体压强不变
(3)一定温度下,向1L密闭容器中加入1molHI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
①0~2min内的平均反应速率v(HI)=___.
②下列关于化学反应速率的说法正确的是___.
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率常用单位时间内任何一种反应物物质的量的减小或生成物物质的量的增加来表示
C.在一定条件下,可逆反应达到化学平衡状态时,正、逆反应的速率不再改变
D.增大反应物的浓度、降低反应的温度都能增大反应速率
③A点的逆反应速率v逆(H2)___B点的正反应速率v正(H2)(填“大于”“小于”或“等于”).
▼优质解答
答案和解析
(1)A.硫酸常温下温度,不易分解,故A错误;
B.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故B错误;
C.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故C正确;
D.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故D错误;
故答案为:C;
(2)反应Ⅱ为2HI⇌H2+I2
A.混合气体的颜色不再变化,说明物质浓度不变,反应达到平衡状态,故A正确;
B.反应前后气体质量和体积不变,混合气体的密度始终不改变,不能说明反应达到平衡状态,故B错误;
C.物质浓度和起始量、变化量有关,反应混合物中各组分物质的浓度相等不能说明反应达到平衡状态,故C错误;
D.H2、HI、I2三种物质的反应速率之比为1:2:1,只能说明该反应的正反应速率之比,但不能说明正逆反应速率相同,故D错误;
E.反应前后气体体积不变,压强始终不变,容器中气体压强不变不能说明反应达到平衡状态,故E错误.
故答案为:A;
(3)①由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
=0.1mol/L,用氢气表示的化学反应速率为
=0.05mol/(L.min),
由反应中的化学计量数可知v(HI)=0.05mol/(L.min)×2=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
②A、反应速率快的现象不一定明显,如NaOH与HCl的反应,反应速率慢的现象可能明显,如铁生锈,故A错误;
B、化学反应速率常用单位时间内任何一种反应物物质的量浓度的减小或生成物物质的量浓度的增加来表示,故B错误;
C、在一定条件下,可逆反应达到化学平衡状态时,正、逆反应的速率相等,所以不再改变,故C正确;
D、增大浓度使活化分子数目增多则能使反应速率加快,降低温度使活化分子百分数减小,则能使反应速率减慢,故D错误;
故答案为:C;
③B点反应向正反应方向移动,所以正反应速率v正(H2)在减小,所以A点的正反应速率v正(H2)小于B点的正反应速率v正(H2),又A点为平衡点,逆反应速率v逆(H2)=v正(H2),即A点的逆反应速率v逆(H2)小于B点的正反应速率v正(H2),故答案为:小于.
B.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故B错误;
C.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故C正确;
D.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故D错误;
故答案为:C;
(2)反应Ⅱ为2HI⇌H2+I2
A.混合气体的颜色不再变化,说明物质浓度不变,反应达到平衡状态,故A正确;
B.反应前后气体质量和体积不变,混合气体的密度始终不改变,不能说明反应达到平衡状态,故B错误;
C.物质浓度和起始量、变化量有关,反应混合物中各组分物质的浓度相等不能说明反应达到平衡状态,故C错误;
D.H2、HI、I2三种物质的反应速率之比为1:2:1,只能说明该反应的正反应速率之比,但不能说明正逆反应速率相同,故D错误;
E.反应前后气体体积不变,压强始终不变,容器中气体压强不变不能说明反应达到平衡状态,故E错误.
故答案为:A;
(3)①由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
| 0.1mol |
| 1L |
| 0.1mol/L |
| 2min |
由反应中的化学计量数可知v(HI)=0.05mol/(L.min)×2=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
②A、反应速率快的现象不一定明显,如NaOH与HCl的反应,反应速率慢的现象可能明显,如铁生锈,故A错误;
B、化学反应速率常用单位时间内任何一种反应物物质的量浓度的减小或生成物物质的量浓度的增加来表示,故B错误;
C、在一定条件下,可逆反应达到化学平衡状态时,正、逆反应的速率相等,所以不再改变,故C正确;
D、增大浓度使活化分子数目增多则能使反应速率加快,降低温度使活化分子百分数减小,则能使反应速率减慢,故D错误;
故答案为:C;
③B点反应向正反应方向移动,所以正反应速率v正(H2)在减小,所以A点的正反应速率v正(H2)小于B点的正反应速率v正(H2),又A点为平衡点,逆反应速率v逆(H2)=v正(H2),即A点的逆反应速率v逆(H2)小于B点的正反应速率v正(H2),故答案为:小于.
看了硫-碘循环分解水制氢主要涉及下...的网友还看了以下:
Fe+Br2=Fe+S=FeBr2+Br2=CaO+SiO2=Na2O+O2=Na+O2=Zn+I 2020-05-20 …
(2011•上海)根据碘与氢气反应的热化学方程式(i)I2(g)+H2(g)⇌2HI(g)+9.4 2020-07-05 …
根据碘与氢气反应的热化学方程式(1)I2(g)+H2(g)⇌2HI(g)△H=-9.48kJ/mo 2020-07-19 …
根据碘与氢气反应的热化学方程式(i)I2(g)+H2(g)⇌2HI(g)△H=-9.48kJ/mo 2020-07-19 …
根据碘与氢气反应的热化学方程式:H2(g)+I2(g)⇌2HI(g)△H=-26.48kJ•mol 2020-07-19 …
碘与氢气一定条件下反应的热化学方程式如下,下列判断正确的是()(Ⅰ)I2(g)+H2(g)⇌2HI 2020-07-19 …
如图所示电源电压不变,当电路中S接1时,R1与R3的电压之比:U1:U3=1:3;当S接1时和接2 2020-07-21 …
根据碘与氢气反应的热化学方程式,下列判断正确的是①I2(g)+H2(g)⇌2HI(g)△H=-9.4 2020-12-24 …
碘与氢气一定条件下反应的热化学方程式如下(Ⅰ)I2(g)+H2(g)═2HI(g)△H=-9.48K 2020-12-24 …
数学问题求解1.在同一平面内,直线I1和直线I2满足下列条件:(1)I1与I2没有公共点,则I1与I 2021-01-04 …