早教吧作业答案频道 -->化学-->
二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如图1:某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.
题目详情
二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如图1:
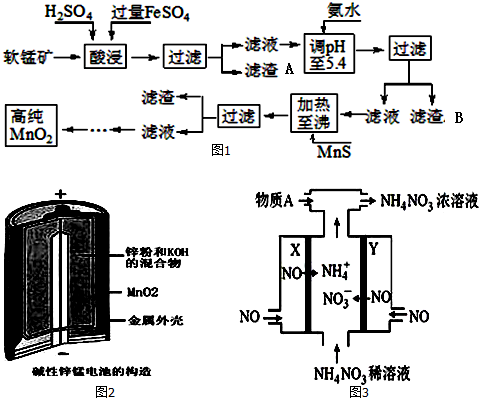
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为___.
(2)滤渣A的主要成分是___;滤渣B的主要成分是___.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.可能原因是___.
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为___,电池总反应的方程式为___.
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极___极,电解时阳极的电极反应为___,使电解产物全部转化为NH4NO3,需补充物质A,A是___.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)滤渣A的主要成分是___;滤渣B的主要成分是___.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.可能原因是___.
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为___,电池总反应的方程式为___.
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极___极,电解时阳极的电极反应为___,使电解产物全部转化为NH4NO3,需补充物质A,A是___.
▼优质解答
答案和解析
软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰,
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后硅不反应,滤渣A为SiO2,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣B的主要成分为Fe(OH)3和Al(OH)3,
故答案为:SiO2,Fe(OH)3和Al(OH)3;
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,
故答案为:CuS、ZnS的溶解度较MnS小;
(4)在反应中Zn元素化合价升高,被氧化,Zn为负极反应,负极电极反应式为Zn+2OH--2e-═Zn(OH)2,Mn元素化合价降低,被还原,MnO2为正极反应,正极反应式为MnO2+H2O+e-═MnOOH+OH-,反应的化学方程式为:Zn+2MnO2+2H2O═2MnOOH+ZnOH)2
故答案为:MnO2+H2O+e-═MnOOH+OH-,Zn+2MnO2+2H2O+2e-═2MnOOH+ZnOH)2;
(5)离子移动方向可知X为阴极,Y为阳极,电解NO制备NH4NO3,Y阳极反应为NO-3e-+2H2O=NO3-+4H+,X阴极反应为:NO+5e-+6H+=NH4++H2O;电解NO制备NH4NO3,阳极反应为5NO-15e-+10H2O=5NO3-+20H-,阴极反应为:3NO+15e-+18H+=3NH4++3H2O,总反应方程式为:8NO+7H2O
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,反应生成硝酸溶液显酸性;
故答案为:阴,NO-3e-+2H2O=NO3-+4H+,NH3;
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后硅不反应,滤渣A为SiO2,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣B的主要成分为Fe(OH)3和Al(OH)3,
故答案为:SiO2,Fe(OH)3和Al(OH)3;
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,
故答案为:CuS、ZnS的溶解度较MnS小;
(4)在反应中Zn元素化合价升高,被氧化,Zn为负极反应,负极电极反应式为Zn+2OH--2e-═Zn(OH)2,Mn元素化合价降低,被还原,MnO2为正极反应,正极反应式为MnO2+H2O+e-═MnOOH+OH-,反应的化学方程式为:Zn+2MnO2+2H2O═2MnOOH+ZnOH)2
故答案为:MnO2+H2O+e-═MnOOH+OH-,Zn+2MnO2+2H2O+2e-═2MnOOH+ZnOH)2;
(5)离子移动方向可知X为阴极,Y为阳极,电解NO制备NH4NO3,Y阳极反应为NO-3e-+2H2O=NO3-+4H+,X阴极反应为:NO+5e-+6H+=NH4++H2O;电解NO制备NH4NO3,阳极反应为5NO-15e-+10H2O=5NO3-+20H-,阴极反应为:3NO+15e-+18H+=3NH4++3H2O,总反应方程式为:8NO+7H2O
| ||
故答案为:阴,NO-3e-+2H2O=NO3-+4H+,NH3;
看了 二氧化锰是制造锌锰干电池的基...的网友还看了以下:
据2010年全国第六次人口普查数据公布,云南省宣威市常住人口为142万人,142万人用科学记数法表 2020-06-11 …
美术沈老师给小画迷冬冬布置了在十天内画若干幅简笔画的作业.冬冬第一天完成了全部作业的1/10,以后 2020-07-10 …
用简便方法算一算(小学题)①25×2.4②0.87×100.1③2.4×4.5×1.25④3.4× 2020-07-19 …
把下面各数按从小到大的顺序排列,并用“<”连接起来1.4261.42•61.4•2•61.•42• 2020-07-19 …
请在半个小时内回复!实在是不会做了,明天要交作业的!1、已知关于x的二次三项式3x²-5x+2m- 2020-07-31 …
小明和小华一起做同样多的口算题,小明做了作业的1/3时,问小华:“你做到哪里了?”小华说:“我还有4 2020-10-30 …
五(1)班学习委员对大家完成作业的情况进行调查做完语文作业的有33人举手,做完数学作业的有42人举手 2020-11-14 …
下列属于法律的有:a.12b.34c.234d.134要交作业的,1.《中国共产党党章》2.《中学生 2020-12-06 …
求两道大一的离散数学题的答案!要交作业的……1.设F(x):x喜欢唱歌,G(x):x有风度,H(x) 2020-12-10 …
解方程:4(x-6)=36列方程,并求方程的解:1.比X少11.5的数是14.42.X的1.5倍等于 2021-01-04 …