早教吧作业答案频道 -->化学-->
已知体积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),请根据化学反应的有关原理同答下列问题(1)一定条件下,充入2molSO2(g)和2molO2(g),20s后,测得SO2的体积百分含
题目详情
已知体积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),请根据化学反应的有关原理同答下列问题
(1)一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为___
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)___.
①混合气体的密度不变
②混合气体的平均相对分子质量不变
③v正(SO2)=2v正(O2)
④各气体的浓度都不再发生变化
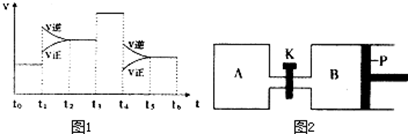
(3)图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3的百分含量最高的是___
A、t2→t3 B、t0→t1 C、t5→t6 D、t3→t4
据图分析:你认为t3时改变的外界条件可能是___;t6时保持体积不变向体系中充入少量SO3,再次平衡后SO2的体积百分含量比t6时___(填“大”、“小”或“等于”).
(4)图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL.试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为___
②若打开K,一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响).

(1)一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为___
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)___.
①混合气体的密度不变
②混合气体的平均相对分子质量不变
③v正(SO2)=2v正(O2)
④各气体的浓度都不再发生变化
(3)图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3的百分含量最高的是___
A、t2→t3 B、t0→t1 C、t5→t6 D、t3→t4
据图分析:你认为t3时改变的外界条件可能是___;t6时保持体积不变向体系中充入少量SO3,再次平衡后SO2的体积百分含量比t6时___(填“大”、“小”或“等于”).
(4)图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL.试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为___
②若打开K,一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响).
▼优质解答
答案和解析
(1)设二氧化硫的转化率为x,则
2SO2(g)+O2(g)⇌2SO3(g)
开始(mol):2 2 0
开始(mol):2x x 2x
平衡(mol):2-2x 2-x 2x
20s后,测得SO2的体积百分含量为12.5%,相同条件下,气体的 体积分数等于物质的量分数,即:
×100%=12.5%,解得x=0.8,
反应消耗的二氧化硫的物质的量为:2mol×0.8mol=1.6mol,用SO2表示该反应在这20s内的反应速率为:v(SO2)=
=0.04mol/(L•s);
故答案为:0.04mol/(L•s);
(2)①混合气体的密度也是时刻不变的,因为反应前后都是气体,质量守恒,而且体积是固定的,故①错误;
②该反应前后质量一定,但是正向是气体物质的量减小的方向,因此这是达到平衡的一个重要标志,故②正确;
③v正(SO2)=2v正(O2)在这个反应中是不管是否达到平衡状态一直存在,无法判断是否达到平衡状态,故③错误;
④各气体的浓度不再变化时,说明正逆反应速率相等,达到了平衡状态,故④正确;
故选②④;
(3)A、t2→t3,在t1时正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向着逆向移动,说明是升高了温度,三氧化硫的含量减小,小于t0→t1;
B、t0→t1 时反应达到了初始平衡状态;
C、t5→t6,正逆反应速率都减小,正反应速率减小的更多,平衡向着逆向移动,说明是减小了压强,三氧化硫的含量减小,小于t3→t4,
所以三氧化硫的含量最高的为t0→t1;
D、t3→t4,正逆反应速率都增大且相等,说明使用了催化剂,化学平衡不移动,三氧化硫的含量不变,与t2→t3相等;
t3时正逆反应速率都增大,且相等,说明使用了催化剂;
t6时保持体积不变向体系中充入少量SO3,相当于增大了压强,达到平衡时二氧化硫转化率增大,二氧化硫的百分含量减小,所以再次平衡后SO2的体积百分含量比t6时减小,
故答案为:B;加入催化剂;减小;
(4)①反应达到平衡时容器B的体积为1.2a L,B为恒压条件下,容器的容积与气体的物质的量成正比,说明达到平衡时气体的物质的量为反应前的1.2倍,即平衡时混合气体的物质的量为2.4mol,气体物质的量之间了0.2mol,设反应消耗了三氧化硫nmol,则
2SO3(g)⇌2SO2(g)+O2(g)△n
2 2 1 1mol
n 0.4mol
n=0.8mol,三氧化硫的转化率为:
100%=40%,
故答案为:40%;
②若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中进入6mol三氧化硫达到的平衡为等效平衡,所以达到平衡时整个容器的容积为:
=3.6a,所以容器B的体积为:3.6a-a=2.6a,
故答案为:2.6a.
2SO2(g)+O2(g)⇌2SO3(g)
开始(mol):2 2 0
开始(mol):2x x 2x
平衡(mol):2-2x 2-x 2x
20s后,测得SO2的体积百分含量为12.5%,相同条件下,气体的 体积分数等于物质的量分数,即:
| 2-2x |
| 2-2x+(2-x)+2x |
反应消耗的二氧化硫的物质的量为:2mol×0.8mol=1.6mol,用SO2表示该反应在这20s内的反应速率为:v(SO2)=
| ||
| 20s |
故答案为:0.04mol/(L•s);
(2)①混合气体的密度也是时刻不变的,因为反应前后都是气体,质量守恒,而且体积是固定的,故①错误;
②该反应前后质量一定,但是正向是气体物质的量减小的方向,因此这是达到平衡的一个重要标志,故②正确;
③v正(SO2)=2v正(O2)在这个反应中是不管是否达到平衡状态一直存在,无法判断是否达到平衡状态,故③错误;
④各气体的浓度不再变化时,说明正逆反应速率相等,达到了平衡状态,故④正确;
故选②④;
(3)A、t2→t3,在t1时正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向着逆向移动,说明是升高了温度,三氧化硫的含量减小,小于t0→t1;
B、t0→t1 时反应达到了初始平衡状态;
C、t5→t6,正逆反应速率都减小,正反应速率减小的更多,平衡向着逆向移动,说明是减小了压强,三氧化硫的含量减小,小于t3→t4,
所以三氧化硫的含量最高的为t0→t1;
D、t3→t4,正逆反应速率都增大且相等,说明使用了催化剂,化学平衡不移动,三氧化硫的含量不变,与t2→t3相等;
t3时正逆反应速率都增大,且相等,说明使用了催化剂;
t6时保持体积不变向体系中充入少量SO3,相当于增大了压强,达到平衡时二氧化硫转化率增大,二氧化硫的百分含量减小,所以再次平衡后SO2的体积百分含量比t6时减小,
故答案为:B;加入催化剂;减小;
(4)①反应达到平衡时容器B的体积为1.2a L,B为恒压条件下,容器的容积与气体的物质的量成正比,说明达到平衡时气体的物质的量为反应前的1.2倍,即平衡时混合气体的物质的量为2.4mol,气体物质的量之间了0.2mol,设反应消耗了三氧化硫nmol,则
2SO3(g)⇌2SO2(g)+O2(g)△n
2 2 1 1mol
n 0.4mol
n=0.8mol,三氧化硫的转化率为:
| 0.8mol |
| 2mol |
故答案为:40%;
②若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中进入6mol三氧化硫达到的平衡为等效平衡,所以达到平衡时整个容器的容积为:
| 6mol |
| 2mol |
故答案为:2.6a.
看了 已知体积为2L的恒容密闭容器...的网友还看了以下:
某同学采集了一些石灰石(有杂质).他将200g稀盐酸(含有盐酸的水溶液)平均分成4份进行实验,结果 2020-05-12 …
现有ABCDEFG七种物质,且ABCDEF均含同种元素,E可使蓝色石蕊试液变红,G是常见气体,F是 2020-06-04 …
再再续化学题在120C°时分别进行以下四个反应:1.2H2s(s)+O2(g)===2H2O(g) 2020-07-09 …
碘溶解于酒精中可配成碘酒溶液,医用碘酒中碘的质量分数为2%,则1.10g碘可配制这种碘酒多少g?2 2020-07-18 …
质量守恒定律有关计算取2.16g物质,使其充分燃烧,测知只生成2.16g水和5.28g二氧化碳.计 2020-07-19 …
甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+H2(g)CH3OH( 2020-07-19 …
下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则 2020-07-19 …
(14分)A、B、C、D、G都是含有同一种短周期元素的化合物,E是氧化物,H是单质。根据下图转化关 2020-07-24 …
1.关于x的不等式(a-1)x<a+5和2x<4的解集相同,则a的值为.2.在1kg含40g食盐的 2020-08-03 …
(1)2.5molBa(OH)2中含有个Ba2+,含有个OH-,2.5molBa(OH)2的质量是g 2020-12-02 …