早教吧作业答案频道 -->化学-->
叠氮化钠(NaN3)常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.(1)实验室制取叠氮化钠的原理、装置及主要步骤如下.ⅰ.2Na+NH3
题目详情
叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.
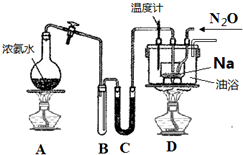
(1)实验室制取叠氮化钠的原理、装置及主要步骤如下.
ⅰ.2Na+NH3
2NaNH2+H2ⅱ.
NaNH2+N2O
NaN3+H2O,
①组装仪器检查装置气密性后,装入药品.装置C中盛放的药品是___.
②实验过程应先点燃___(填“A”或“D”)的酒精灯,理由是___.
③在反应ⅰ充分进行后,通入N2O气体,加热.此时采用油浴而不用水浴的主要原因是___.
(2)装置D反应完全结束后,取出混合物进行以下操作,得到NaN3固体:
D中混合物
NaN3
已知:NaNH2能与水反应生成NaOH和氨气.
操作ⅱ的目的是___;操作ⅳ最好选用的试剂是___.
(3)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数.测定过程反应方程式为
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑.Ce4++Fe2+=Ce3++Fe3+
首先将2.50g试样配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入50.00mL 0.1000mol•L-1(NH4)2Ce(NO3)6,充分反应后,将溶液稍稀释,向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为24.00mL.
①则试样中含NaN3的质量分数为___.
②为了提高该实验的精确度,该实验需要补充___.
(4)消防时,销毁NaN3常用NaClO溶液,该反应过程中只有N2一种气体生成,写出反应方程式___.

(1)实验室制取叠氮化钠的原理、装置及主要步骤如下.
ⅰ.2Na+NH3
| ||
NaNH2+N2O
| ||
①组装仪器检查装置气密性后,装入药品.装置C中盛放的药品是___.
②实验过程应先点燃___(填“A”或“D”)的酒精灯,理由是___.
③在反应ⅰ充分进行后,通入N2O气体,加热.此时采用油浴而不用水浴的主要原因是___.
(2)装置D反应完全结束后,取出混合物进行以下操作,得到NaN3固体:
D中混合物
| 加水 |
| |
| Ⅰ |
| 加乙醇 |
| |
| Ⅱ |
| 过滤 |
| |
| Ⅲ |
| 洗涤 |
| |
| Ⅳ |
| 干燥 |
| |
| Ⅴ |
已知:NaNH2能与水反应生成NaOH和氨气.
操作ⅱ的目的是___;操作ⅳ最好选用的试剂是___.
(3)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数.测定过程反应方程式为
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑.Ce4++Fe2+=Ce3++Fe3+
首先将2.50g试样配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入50.00mL 0.1000mol•L-1(NH4)2Ce(NO3)6,充分反应后,将溶液稍稀释,向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为24.00mL.
①则试样中含NaN3的质量分数为___.
②为了提高该实验的精确度,该实验需要补充___.
(4)消防时,销毁NaN3常用NaClO溶液,该反应过程中只有N2一种气体生成,写出反应方程式___.
▼优质解答
答案和解析
(1)①A中产生的氨气混有水蒸气,干燥氨气选择碱石灰,则在C中盛放的药品是碱石灰,
故答案为:碱石灰;
②实验过程中先点燃A产生氨气将装置内空气驱赶除去,防止产品不纯,
故答案为:A;先产生NH3,将装置内空气驱赶除去,防止产品不纯;
③NaNH2+N2O
NaN3+H2O,水浴温度达不到反应所需的温度210℃-220℃,
故答案为:水浴温度达不到反应所需的温度210℃-220℃;
(2)D中混合物加水后,根据叠氮化钠 (NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,NaN3溶解在水中,NaNH2与水反应生成NaOH和氨气,可知操作Ⅱ加乙醇可降低NaN3的溶解度促使NaN3析出;乙醚洗涤叠氮化钠可减少叠氮化钠的损失,
故答案为:降低NaN3的溶解量或溶解度或促使NaN3析出;乙醚;
(3)①计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸,用0.0500mol•L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算:
n[(NH4)2Ce(NO3)6]=0.1000mol•L-1×50.00×10-3L=5.000×10-3mol,
n[(NH4)2Fe(SO4)2]=0.0500mol•L-1×24.00×10-3L=1.200×10-3mol,
与NaN3反应的n[(NH4)2Ce(NO3)6]=5.000×10-3mol-1.200×10-3mol=3.800×10-3mol,
ω=
×100%=98.8%,
故答案为:98.8%;
②为了提高该实验的精确度,氧化还原反应滴定实验一般要用平行实验,求平均值,
故答案为:平行实验;
(4)根据氮元素化合价高,氯元素化合价降低且只有N2一种气体生成,则氯只能从+1降到-1价,其他元素化合价不变,水参加反应,生成氯化钠、氮气、氢氧化钠,
则反应方程式为:2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH,
故答案为:2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH.
故答案为:碱石灰;
②实验过程中先点燃A产生氨气将装置内空气驱赶除去,防止产品不纯,
故答案为:A;先产生NH3,将装置内空气驱赶除去,防止产品不纯;
③NaNH2+N2O
| ||
故答案为:水浴温度达不到反应所需的温度210℃-220℃;
(2)D中混合物加水后,根据叠氮化钠 (NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,NaN3溶解在水中,NaNH2与水反应生成NaOH和氨气,可知操作Ⅱ加乙醇可降低NaN3的溶解度促使NaN3析出;乙醚洗涤叠氮化钠可减少叠氮化钠的损失,
故答案为:降低NaN3的溶解量或溶解度或促使NaN3析出;乙醚;
(3)①计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸,用0.0500mol•L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算:
n[(NH4)2Ce(NO3)6]=0.1000mol•L-1×50.00×10-3L=5.000×10-3mol,
n[(NH4)2Fe(SO4)2]=0.0500mol•L-1×24.00×10-3L=1.200×10-3mol,
与NaN3反应的n[(NH4)2Ce(NO3)6]=5.000×10-3mol-1.200×10-3mol=3.800×10-3mol,
ω=
| 3.800×10-3mol×65g/mol | ||
2.50g×
|
故答案为:98.8%;
②为了提高该实验的精确度,氧化还原反应滴定实验一般要用平行实验,求平均值,
故答案为:平行实验;
(4)根据氮元素化合价高,氯元素化合价降低且只有N2一种气体生成,则氯只能从+1降到-1价,其他元素化合价不变,水参加反应,生成氯化钠、氮气、氢氧化钠,
则反应方程式为:2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH,
故答案为:2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH.
看了 叠氮化钠(NaN3)常作为汽...的网友还看了以下:
下列关于氮的叙述中不正确的是A.氮气的性质非常稳定,主要是因为氮氮叁键很牢固所致B.氮是氮族中非金 2020-05-13 …
下列关于氮的固定的说法错误的是()A.氮的固定包括人工固氮和自然固氮B.工业合成氨属于人工固氮C. 2020-05-14 …
下列变化属于氮的固定的是A.N2和H2在一定条件下反应生成NH3B.NO与O2反应生成NO2C.N 2020-05-14 …
请问什么是土壤盐度?它的单位是什么?和土壤电导率有什么关系?在一些土种志中还涉及到全氮、全磷、全钾 2020-05-17 …
(2014•嘉定区二模)下列关于氮及其化合物的表述完全正确的是()A.氮原子最外层电子的轨道表示式 2020-06-27 …
褐球固氮菌于有氧状态下,在无氮培养中生长时,通过固定空气中氮取得它所需要的氮,在1标准大气压和30 2020-07-14 …
下列关于提取胡萝卜素的相关知识的描述,正确的是()A.胡萝卜素可根据其分子式中氮氮双键分为α、β、γ 2020-11-03 …
下列关于提取胡萝卜素的相关知识的描述,正确的是()A.胡萝卜素的可根据其分子式中氮氮双键分为α、β、 2020-11-03 …
氨可用于制取氨水、液氮、氮肥(尿素、碳铵等)、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、 2020-12-18 …
科学制定“十二五”规划,对于继续抓住和用好我国发展的重要战略机遇期、促进经济长期平稳较快发展,对于夺 2020-12-20 …