早教吧作业答案频道 -->化学-->
氨可用于制取氨水、液氮、氮肥(尿素、碳铵等)、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业中,是重要的化工产品.(1)以甲烷为原料可
题目详情
氨可用于制取氨水、液氮、氮肥(尿素、碳铵等)、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业中,是重要的化工产品.
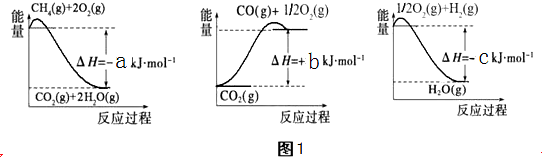
(1)以甲烷为原料可制得合成氨气用的氢气.有关化学反应的能量变化如图1所示.则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___.
(2)已知N2(g)+3H2⇌2NH3(g)△H=-94.4kJ•mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示.
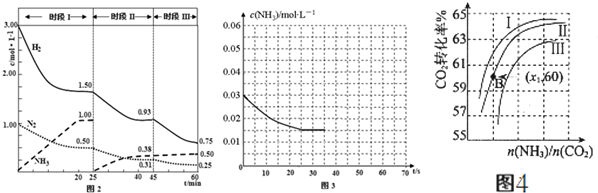
①25min时采取的措施是___.
②在实际制氨气工业生产中和该措施的目的相同的其它措施还有___.
(3)①CO可使合成氨的催化剂中毒而失去活性,因此工业上常用乙酸二氨合铜(I)溶液来吸收原料气体中的CO,反应原理:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌[Cu(NH3)3]CH3COO•CO(l)△H<0,吸收后的乙酸铜氨溶液经过适当处理后可再生而恢复其吸收CO的能力,则再生的适宜条件是___.(填字母序号).
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
②在一恒温恒容的密闭容器中,按照1:1充入一定物质的量的CO和NH3气体与足量的乙酸二氨合铜(I)溶液反应,容器中氨气的物质的量浓度随时间的变化如图3所示.若在35s时再充入原物质的量的CO和NH3气体后,请在图3中画出氨气的物质的量浓度随时间变化图.
(4)①用氨气制取尿素[CO(NH2)]的反应为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容器为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%.则该反应的平衡常数K=___.
②在实际工业生产中,原料气带有水蒸气,图4表示CO2的转化率与氨碳比
、水碳比
的变化关系.
a、曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比(n(H2O)/n(CO2))最大的是___.
b、测得B点氨的转化率为40%,则x1=___.
(1)以甲烷为原料可制得合成氨气用的氢气.有关化学反应的能量变化如图1所示.则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___.

(2)已知N2(g)+3H2⇌2NH3(g)△H=-94.4kJ•mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示.

①25min时采取的措施是___.
②在实际制氨气工业生产中和该措施的目的相同的其它措施还有___.
(3)①CO可使合成氨的催化剂中毒而失去活性,因此工业上常用乙酸二氨合铜(I)溶液来吸收原料气体中的CO,反应原理:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌[Cu(NH3)3]CH3COO•CO(l)△H<0,吸收后的乙酸铜氨溶液经过适当处理后可再生而恢复其吸收CO的能力,则再生的适宜条件是___.(填字母序号).
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
②在一恒温恒容的密闭容器中,按照1:1充入一定物质的量的CO和NH3气体与足量的乙酸二氨合铜(I)溶液反应,容器中氨气的物质的量浓度随时间的变化如图3所示.若在35s时再充入原物质的量的CO和NH3气体后,请在图3中画出氨气的物质的量浓度随时间变化图.
(4)①用氨气制取尿素[CO(NH2)]的反应为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容器为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%.则该反应的平衡常数K=___.
②在实际工业生产中,原料气带有水蒸气,图4表示CO2的转化率与氨碳比
| n(NH3) |
| n(CO2) |
| n(H2O) |
| n(CO2) |
a、曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比(n(H2O)/n(CO2))最大的是___.
b、测得B点氨的转化率为40%,则x1=___.
▼优质解答
答案和解析
(1)图象分析反应过程都是能量降低的过程,反应的热化学方程式为:
①CO(g)+
O2(g)=CO2(g)△H=+bKJ/mol
②H2(g)+
O2(g)=H2O(g)△H=-cKJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-bKJ/mol
由盖斯定律③-②×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1;
(2)①25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
②在实际制氨气工业生产中和该措施的目的相同的其它措施还有高压、原料气循环利用等方法,故答案为:高压、原料气循环利用等;
(3)①吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压,
故答案为:B;
②若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示: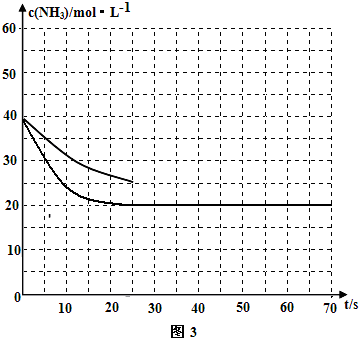 ,
,
故答案为: ;
;
(4)①某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%,转化的二氧化碳为1mol,则:
2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)
起始量(mol):4 2 0
变化量(mol):2 1 1
平衡量(mol):2 1 1
则平衡常数K=
=
=2500L2•mol-2,
故答案为:2500;
②a、氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
b、由题意可知:2NH3(g)+CO2(g)⇌CO(NH2)2+H2O(g)
起始量 x1 1
变化量 2a a
即:
=40%,
=60%,则x1=3,
故答案为:3.
①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-bKJ/mol
由盖斯定律③-②×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1;
(2)①25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
②在实际制氨气工业生产中和该措施的目的相同的其它措施还有高压、原料气循环利用等方法,故答案为:高压、原料气循环利用等;
(3)①吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压,
故答案为:B;
②若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示:
 ,
,故答案为:
 ;
;(4)①某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%,转化的二氧化碳为1mol,则:
2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)
起始量(mol):4 2 0
变化量(mol):2 1 1
平衡量(mol):2 1 1
则平衡常数K=
| c(H2O) |
| c2(NH3)×c(CO2) |
| ||||
(
|
故答案为:2500;
②a、氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
b、由题意可知:2NH3(g)+CO2(g)⇌CO(NH2)2+H2O(g)
起始量 x1 1
变化量 2a a
即:
| 2a |
| x1 |
| a |
| 1 |
故答案为:3.
看了氨可用于制取氨水、液氮、氮肥(...的网友还看了以下:
邻间位羟基苯甲醛与1-溴代十二烷在碱性条件下反应(今年国初题) 2020-03-30 …
胺环与环氧氯丙烷的反应环氧氯丙烷在碱性条件下可以脱去HCL再生成环氧基.这个反应的温度和时间是多少 2020-05-17 …
有关人不同思维的人生哲理?集合思维,矛盾思维,交叉思维,分解思维,逆向思维,平行思维例如:平行思维 2020-06-05 …
二氯甲烷片碱丁基溶纤剂能退掉ABS上的各种油漆吗 2020-06-09 …
溴乙烷在碱性条件下水解化学方程式 2020-06-13 …
卤代烷在碱性条件下发生水解反应,碱的作用是什么 2020-06-28 …
实验室制取甲烷中碱石灰的作用写出3点1---------2---------3--------- 2020-11-10 …
下列大小比较正确的是()A.稳定性:HI>HBr>HCl>HFB.元素非金属性:Si>P>S>ClC 2020-12-24 …
用下列物质的序号填空:①甲烷②烧碱③氧气④碳酸氢钠⑤熟石灰(1)可用于气割、气焊的单质是;(2)天然 2021-01-22 …
现有①168O、188O②H2、D2、T2③氯水、液氯④丙烷、异丁烷⑤异戊烷、新戊烷⑥火碱、烧碱等六 2021-02-01 …