早教吧作业答案频道 -->化学-->
现有铜与金属镁、铁、锌中的一种组成的混合物,现欲测定其组成查阅资料镁、铁、锌皆能与稀硫酸发生置换反应且生成+2价的可溶性金属化合物和氢气实验步骤及数据取该混合物
题目详情
现有铜与金属镁、铁、锌中的一种组成的混合物,现欲测定其组成
【查阅资料】
镁、铁、锌皆能与稀硫酸发生置换反应且生成+2价的可溶性金属化合物和氢气
【实验步骤及数据】
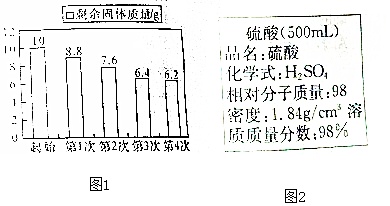
取该混合物粉末10g放入烧杯中,将140.0g溶质的质量分数为14.0%的稀硫酸平均分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如图1:
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该合金是铜与哪种金属组成的?
(3)实验室有一瓶浓硫酸,仔细观察标签如图2,现要将100g这种浓硫酸稀释为质量分数为实验所用的稀硫酸,需要加水的质量是___
【查阅资料】
镁、铁、锌皆能与稀硫酸发生置换反应且生成+2价的可溶性金属化合物和氢气
【实验步骤及数据】
取该混合物粉末10g放入烧杯中,将140.0g溶质的质量分数为14.0%的稀硫酸平均分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如图1:
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该合金是铜与哪种金属组成的?
(3)实验室有一瓶浓硫酸,仔细观察标签如图2,现要将100g这种浓硫酸稀释为质量分数为实验所用的稀硫酸,需要加水的质量是___

▼优质解答
答案和解析
解(1)混合物粉末中铜的质量分数是:
×100%=62%,
答:该混合物粉末中铜的质量分数62%.
(2)设该金属化学式为R,原子量为M,
R+H2SO4=RSO4+H2↑,
M 98
1.2g 35gx14%
=
,
M=24,
因为镁的相对原子质量是24,锌的相对原子质量是65,因此混合物中另一种金属是镁.
答:该合金是铜与镁组成的.
(3)设100g这种浓硫酸稀释为质量分数为14%的硫酸,需要水的质量为x.
100g×98%═(100g+x)×14%,解得x═600g.
答:现要将100g这种浓硫酸稀释为质量分数为实验所用的稀硫酸,需要加水的质量是600g.
| 6.2g |
| 8.0g |
答:该混合物粉末中铜的质量分数62%.
(2)设该金属化学式为R,原子量为M,
R+H2SO4=RSO4+H2↑,
M 98
1.2g 35gx14%
| M |
| 1.2g |
| 98 |
| 35g×14% |
M=24,
因为镁的相对原子质量是24,锌的相对原子质量是65,因此混合物中另一种金属是镁.
答:该合金是铜与镁组成的.
(3)设100g这种浓硫酸稀释为质量分数为14%的硫酸,需要水的质量为x.
100g×98%═(100g+x)×14%,解得x═600g.
答:现要将100g这种浓硫酸稀释为质量分数为实验所用的稀硫酸,需要加水的质量是600g.
看了 现有铜与金属镁、铁、锌中的一...的网友还看了以下:
下列图例可以形象地表示某化学反应前后反应物和生成物分子及其数目的变化,其中分下列图例可以形象地表示 2020-05-16 …
化学方程式的含义?从量的方面:1微观上表示反应物和生成物之间粒子(质量)之比……1微观上表示反应物 2020-07-15 …
现有一杯饱和溶液中溶有46克的硝酸亚铁、94克的硝酸铜和213克的硝酸银,先放入一块252克合金, 2020-07-19 …
根据反应物和生成物的类别及反应前后物质种类的多少把化学反应分为、、和.根据反应中是否有化合价的升降 2020-07-20 …
对化学反应进行分类是学习和掌握物质的化学性质的重要方法之一。“以反应物和生成物的类别以及反应前后物 2020-07-20 …
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质.气体B与气体C相 2020-11-07 …
英语中哪些动词不及物和及物怎样区分例如sinksubside同样有下沉的意思但是sink有及物使下沉 2020-11-28 …
某反应体系中的物质有:A12O3、AlN、C、N2、CO2(1)请将A12O3之外的反应物和生成物及 2020-12-25 …
某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.已知H2S在反应中失去 2020-12-25 …
热化学方程式中的△H实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关 2021-01-11 …