早教吧作业答案频道 -->化学-->
磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5(P04)3F+21Si02+30C═3P4+20CaSi03
题目详情
磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:
(1)上述元素中,位于第二周期的元素第一电离能由大到小的顺序为___.
(2)请写出两种CO的等电子体的化学式___.
(3)Si晶体中存在与金刚石结构类似的晶体,其中原子与原子之间以___
相结合,其晶胞中共有8个Si原子,其中在面心位置贡献___个Si原子.SiF4虽然也是硅的化合物,但是沸点比Si02低很多.原因是:___
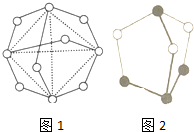
(4)白磷在空气中燃烧的一种生成物分子的结构如图1所示.其中圆圈表示原子,实线表示化化学键.分子中P原子的杂化方式为___.
(5)如图2为一种磷的硫化物的结构,有关该物质的说法中正确的是___
A.该物质的化学式为P4S3
B.该物质分子中含有σ键和π键
C.该物质中P元素的化合价为+3价
D.该物质的晶体中每个分子的配位数为12
(6)Ca元素位于周期表的___区,基态钙原子的电子排布式为___,Ca单质为面心立方晶体,一个晶胞中含___个Ca原子,已知Ca原子的半径为174pm列式表示Ca单质的密度___g•cm-3(不必计算出结果).

(1)上述元素中,位于第二周期的元素第一电离能由大到小的顺序为___.
(2)请写出两种CO的等电子体的化学式___.
(3)Si晶体中存在与金刚石结构类似的晶体,其中原子与原子之间以___
相结合,其晶胞中共有8个Si原子,其中在面心位置贡献___个Si原子.SiF4虽然也是硅的化合物,但是沸点比Si02低很多.原因是:___
(4)白磷在空气中燃烧的一种生成物分子的结构如图1所示.其中圆圈表示原子,实线表示化化学键.分子中P原子的杂化方式为___.
(5)如图2为一种磷的硫化物的结构,有关该物质的说法中正确的是___
A.该物质的化学式为P4S3
B.该物质分子中含有σ键和π键
C.该物质中P元素的化合价为+3价
D.该物质的晶体中每个分子的配位数为12
(6)Ca元素位于周期表的___区,基态钙原子的电子排布式为___,Ca单质为面心立方晶体,一个晶胞中含___个Ca原子,已知Ca原子的半径为174pm列式表示Ca单质的密度___g•cm-3(不必计算出结果).
▼优质解答
答案和解析
(1)上述元素中,位于第二周期的元素为C、O、F,同周期随原子序数增大,元素第一电离能呈增大趋势,注意ⅡA、ⅤA族元素第一电离能高于同周期相邻元素,故第一电离能F>O>C,
故答案为:F>O>C;
(2)原子总数相等、价电子总数相等的微粒互为等电子体,与CO的等电子体的微粒为N2、CN-等,
故答案为:N2、CN-;
(3)Si晶体中存在与金刚石结构类似的晶体,属于原子晶体,硅原子与氧原子之间形成共价键;晶胞中有4个Si原子处于晶胞体内,其它Si原子处于面心、顶点上,在面心位置贡献Si原子数为6×
=3;
SiF4属于分子晶体,熔化时破坏范德华力,SiO2属于原子晶体,熔化时破坏共价键,故二氧化硅的沸点较高,
故答案为:共价键;3;SiF4属于分子晶体,熔化时破坏范德华力,SiO2属于原子晶体,熔化时破坏共价键;
(4)图中形成2个共价键的原子为O原子,形成3个共价键的原子为P原子,P原子还有1对孤对电子,P原子杂化轨道数目为4,分子中P原子的杂化方式为sp3,
故答案为:sp3;
(5)A.根据原子形成化学键数目可知,白色球为S原子、黑色球为P原子,则该化合物化学式为P4S3,故A正确;
B.该分子中不含π键,故B错误;
C.根据化合价代数和为0,可知P4S3中P的平均化合价为
=+1.5,故C错误;
D.属于分子晶体,为面心立方最密堆积,配位数为12,故D正确,
故选:AD;
(6)Ca元素原子外围电子排布为4s2,处于周期表中s区,原子核外有20个电子,核外电子排布式式为:1s22s22p63s23p64s2,Ca单质为面心立方晶体,一个晶胞中含Ca原子数目为8×
+6×
=4,晶胞质量为4×
g,Ca原子的半径为174pm,则晶胞棱长为4×174×10-10 cm×
=2
×174×10-10 cm,则晶胞密度=4×
g÷(2
×174×10-10 cm)3=
g/cm3,
故答案为:s;1s22s22p63s23p64s2;4;
.
故答案为:F>O>C;
(2)原子总数相等、价电子总数相等的微粒互为等电子体,与CO的等电子体的微粒为N2、CN-等,
故答案为:N2、CN-;
(3)Si晶体中存在与金刚石结构类似的晶体,属于原子晶体,硅原子与氧原子之间形成共价键;晶胞中有4个Si原子处于晶胞体内,其它Si原子处于面心、顶点上,在面心位置贡献Si原子数为6×
| 1 |
| 2 |
SiF4属于分子晶体,熔化时破坏范德华力,SiO2属于原子晶体,熔化时破坏共价键,故二氧化硅的沸点较高,
故答案为:共价键;3;SiF4属于分子晶体,熔化时破坏范德华力,SiO2属于原子晶体,熔化时破坏共价键;
(4)图中形成2个共价键的原子为O原子,形成3个共价键的原子为P原子,P原子还有1对孤对电子,P原子杂化轨道数目为4,分子中P原子的杂化方式为sp3,
故答案为:sp3;
(5)A.根据原子形成化学键数目可知,白色球为S原子、黑色球为P原子,则该化合物化学式为P4S3,故A正确;
B.该分子中不含π键,故B错误;
C.根据化合价代数和为0,可知P4S3中P的平均化合价为
| 2×3 |
| 4 |
D.属于分子晶体,为面心立方最密堆积,配位数为12,故D正确,
故选:AD;
(6)Ca元素原子外围电子排布为4s2,处于周期表中s区,原子核外有20个电子,核外电子排布式式为:1s22s22p63s23p64s2,Ca单质为面心立方晶体,一个晶胞中含Ca原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 40 |
| 6.02×1023 |
| ||
| 2 |
| 2 |
| 40 |
| 6.02×1023 |
| 2 |
| 4×40 | ||
6.02×1023×(2
|
故答案为:s;1s22s22p63s23p64s2;4;
| 4×40 | ||
6.02×1023×(2
|
看了 磷单质及其化合物在工业上有广...的网友还看了以下:
超音速飞机声音传播速度和温度有关-20度声速是318m/s,30度时是348m/s,随温度的增加声速 2020-03-31 …
氨气受高温能有啥反应空气里氨气大,用风机吹进炉内加热管,升高个二十度吧(汗.),氨气有啥动静没?催 2020-05-13 …
9.读东京和北京气温和年降水量对比表。与北京相比,东京的气候特点是()城市最冷月(1月)均温最热月 2020-05-13 …
太阳能路灯蓄电池地埋标准这个和气温是有关系的吗 我想知道 这个有标准可循吗 各地温度的高低 和地埋 2020-05-16 …
在不同温度和湿度条件下,蝗虫种群数量的变化如下图所示,叙述正确的是[]A.温度为32.5℃时,蝗虫 2020-05-16 …
疑惑!关于气体状态变化一定质量的理想气体体积不变时压强的增加量都相同吗还是温度高增量大用pV=nR 2020-06-17 …
温良恭俭让谁知道经典中对此五种美德的解释,或名句,不是现代汉语的解释温良恭俭让温良恭俭让是传统美德 2020-06-20 …
读渤、黄、东海2月(甲图)和8月(乙图)多年月平均海水表面温度的空间分布图,回答下列问题。(15分) 2020-11-02 …
周末,小红在家帮助妈妈洗衣服,妈妈叫她把洗衣粉放入温水洗污渍多的衣服,容易去污,由此引起了她的探究: 2020-11-05 …
为什么化学平衡常数只与温度有关而与浓度,压强无关(用高中知识回答)为什么化学平衡常数只与温度有关而与 2020-11-06 …