早教吧作业答案频道 -->化学-->
掺杂微量铜、硼、钾、硒等元素的单晶硅太阳能电池是第三代太阳能电池之一.(1)Cu2+的电子排布式为.(2)已知铜转化为水合离子过程如下:已知I1=745.5kJ•mol-1,I2=1957.3kJ•mol-1.在水
题目详情
掺杂微量铜、硼、钾、硒等元素的单晶硅太阳能电池是第三代太阳能电池之一.
(1)Cu2+的电子排布式为___.
(2)已知铜转化为水合离子过程如下:

已知I1=745.5kJ•mol-1,I2=1957.3kJ•mol-1.在水溶液中Cu2+比Cu+更稳定的原因是___.
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2.1mol(SCN)2含有π键的数目为___.HSCN有两种结构,H-S-C=N(硫氰酸)的沸点低于H-N=C=S(异硫氰酸)的沸点,其原因是___.
(4)BF3能与NH3坟茔生成配合物BF3•NH3,该配合物中B原子的杂化方式为___.
(5)铜和硒可形成的半导体团簇分子的球棍模型如甲所示,其分子式为___.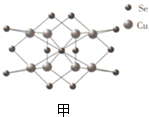
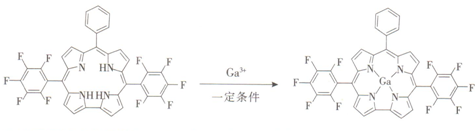
(6)镓与某有机物形成的配合物过程如图,在图上画出产物中的配位键.
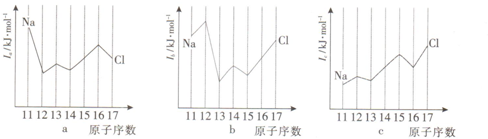
(7)与Si同周期部分元素的电离能如图所示,其中a、b、c分别代表___.
A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2.
(1)Cu2+的电子排布式为___.
(2)已知铜转化为水合离子过程如下:

已知I1=745.5kJ•mol-1,I2=1957.3kJ•mol-1.在水溶液中Cu2+比Cu+更稳定的原因是___.
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2.1mol(SCN)2含有π键的数目为___.HSCN有两种结构,H-S-C=N(硫氰酸)的沸点低于H-N=C=S(异硫氰酸)的沸点,其原因是___.
(4)BF3能与NH3坟茔生成配合物BF3•NH3,该配合物中B原子的杂化方式为___.
(5)铜和硒可形成的半导体团簇分子的球棍模型如甲所示,其分子式为___.

(6)镓与某有机物形成的配合物过程如图,在图上画出产物中的配位键.

(7)与Si同周期部分元素的电离能如图所示,其中a、b、c分别代表___.

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2.
▼优质解答
答案和解析
(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式为1s22s22p63s23p63d9;原子轨道中电子处于半满、全满、全空时最稳定,二价铜离子价电子排布式为3d9、亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,所以较稳定,
故答案为:1s22s22p63s23p63d9;
(2)Cu(g)~Cu+(g),铜的第一第一电离能为745.5kJ/mol,亚铜离子结合水放热582KJ,Cu(g)~Cu+(g)~Cu2+(g),铜离子结合水分子放热2121KJ,由电离能、Cu+和 Cu2+ 与水结合放出的热量数据可知,Cu+(g)转化Cu2+ (g)再与水结合比Cu+(g)直接水合放出的热量更多,因而在溶液中Cu2+更稳定,
故答案为:由电离能、Cu+和 Cu2+ 与水结合放出的热量数据可知,Cu+(g)转化Cu2+ (g)再与水结合比Cu+(g)直接水合放出的热量更多,因而在溶液中Cu2+更稳定;
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;
能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(4)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3.在BF3•NH3中B原子价层电子对个数是4,根据价层电子对互斥理论确定B原子的杂化方式为sp3,
故答案为:sp3;
(5)分子的球棍模型中含铜原子8个含硒原子13个,则分子式为Cu8Se13,故答案为:Cu8Se13;
(6)镓原子和氮原子间形成配位键,由氮原子单方面提供电子对,和镓原子间形成四个配位键,画出的配位键图示为: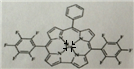
故答案为: ;
;
(7)在第三周期元素中,钠失去1个电子后,就已经达到稳定结构,所以钠的第二电离能最大,镁最外层为2个电子,失去2个电子后为稳定结构,所以镁的第二电离能较小,铝最外层有3个电子,失去2个电子后还未达稳定结构,而铝的金属性比镁弱,所以第二电离能比镁略高,硅最外层上2p层有2个电子,失去后,留下2s轨道上有2个电子,相对较稳定,所以硅的第二电离能比铝要低,磷、硫非金属性逐渐增大,第二电离能也增大,由于硫失去一个电子后,3p轨道上是3个电子,是较稳定结构,所以硫的第二电离能要高于氯,a为第二电离能为I2、b为第三电离能为I3、c为第一电离能为I1,选B,
故答案为:B.
故答案为:1s22s22p63s23p63d9;
(2)Cu(g)~Cu+(g),铜的第一第一电离能为745.5kJ/mol,亚铜离子结合水放热582KJ,Cu(g)~Cu+(g)~Cu2+(g),铜离子结合水分子放热2121KJ,由电离能、Cu+和 Cu2+ 与水结合放出的热量数据可知,Cu+(g)转化Cu2+ (g)再与水结合比Cu+(g)直接水合放出的热量更多,因而在溶液中Cu2+更稳定,
故答案为:由电离能、Cu+和 Cu2+ 与水结合放出的热量数据可知,Cu+(g)转化Cu2+ (g)再与水结合比Cu+(g)直接水合放出的热量更多,因而在溶液中Cu2+更稳定;
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;
能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(4)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3.在BF3•NH3中B原子价层电子对个数是4,根据价层电子对互斥理论确定B原子的杂化方式为sp3,
故答案为:sp3;
(5)分子的球棍模型中含铜原子8个含硒原子13个,则分子式为Cu8Se13,故答案为:Cu8Se13;
(6)镓原子和氮原子间形成配位键,由氮原子单方面提供电子对,和镓原子间形成四个配位键,画出的配位键图示为:

故答案为:
 ;
;(7)在第三周期元素中,钠失去1个电子后,就已经达到稳定结构,所以钠的第二电离能最大,镁最外层为2个电子,失去2个电子后为稳定结构,所以镁的第二电离能较小,铝最外层有3个电子,失去2个电子后还未达稳定结构,而铝的金属性比镁弱,所以第二电离能比镁略高,硅最外层上2p层有2个电子,失去后,留下2s轨道上有2个电子,相对较稳定,所以硅的第二电离能比铝要低,磷、硫非金属性逐渐增大,第二电离能也增大,由于硫失去一个电子后,3p轨道上是3个电子,是较稳定结构,所以硫的第二电离能要高于氯,a为第二电离能为I2、b为第三电离能为I3、c为第一电离能为I1,选B,
故答案为:B.
看了 掺杂微量铜、硼、钾、硒等元素...的网友还看了以下:
1).已知R、L串联电路,其电阻R和XL均为10Ω,当在电路上加100ν交流电压时,求电路中的电流 2020-04-25 …
电流I、电阻R、电功率P之间满足关系式P=I^2R.已知P=5W,回答下列(1)变量R是变量I的函 2020-06-14 …
三相电机80KW算电流.常用的经验算法是80*2=电流160安标准计算公式:P=1.732*U*I 2020-06-24 …
利用电能公式W=IUt和欧姆定律I=U/R推导:(1)w=I的平方乘以R乘以t.(2)W=U的平方 2020-07-15 …
怎么知道i的多少?i是电解质的一个分子在溶液中能产生的质点数,非电解质的i是1,电解质有的是2或3 2020-07-29 …
交流电的电流强度i(A)与时间t(s)的关系满足函数解析式i=5sin(100πt+π3),t∈[ 2020-07-30 …
表1、2是某实验中得到的两组数据,分析表1可得出的结论是;分析表2可得出的结论是;综合分析表1、2 2020-08-03 …
如图为某交流电的电流I与时间t的关系式:I=Asin(ωt+ϕ)的一段图象.(Ⅰ)根据图象写出I=A 2020-11-07 …
一道物理题若流过2H电感元件的电流为i(t)=1.5A,求在t=2s时的储能.解:W=1/2Li(t 2020-12-05 …
有一根粗细不均匀的导线,己知粗细端横截面积之比为2:1,当有电流通过这一导线时,通过粗端的电流I粗与 2021-01-12 …