早教吧作业答案频道 -->化学-->
新型电池在飞速发展的信息技术中发挥着越来越重要的作用.Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用.其中一种制备Li2FeSi
题目详情
新型电池在飞速发展的信息技术中发挥着越来越重要的作用.Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用.其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4
Li2FeSiO4+Li2SO4+SiO2
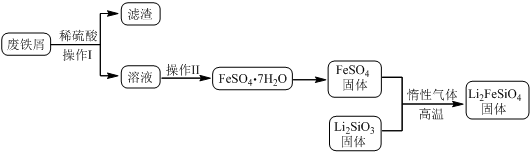
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
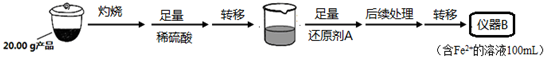
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
(1)实验(二)中的仪器名称:仪器B___,仪器C___.
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是___.
(3)操作Ⅱ的步骤___,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需___.
(4)还原剂A可用SO2,写出该反应的离子方程式___,此时后续处理的主要目的是___.
(5)滴定终点时现象为___;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为___;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量___.(填“偏高”、“偏低”或“不变”).
固相法:2Li2SiO3+FeSO4
| ||
| 高温 |
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:

实验(二) Li2FeSiO4含量测定:

从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是___.
(3)操作Ⅱ的步骤___,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需___.
(4)还原剂A可用SO2,写出该反应的离子方程式___,此时后续处理的主要目的是___.
(5)滴定终点时现象为___;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为___;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量___.(填“偏高”、“偏低”或“不变”).
▼优质解答
答案和解析
(1)实验二中仪器B为配制溶液需要的容量瓶,得到含Fe2+离子的溶液100ml,需要仪器为100ml容量瓶,仪器C为滴定实验所用的标准溶液,标准溶液为高锰酸钾溶液具有氧化性能腐蚀橡胶管,需要盛放在酸式滴定管中,
故答案为:100ml容量瓶,酸式滴定管;
(2)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,因为亚铁离子具有还原性,易被氧化,所以惰性气体氛围中是为了防止亚铁离子被氧化,
故答案为:防止二价铁被氧化;
(3)操作Ⅱ是溶液中得到硫酸亚铁晶体的实验操作,蒸发浓缩,降温结晶,过滤洗涤得到;操作Ⅰ是分离固体和溶液的方法需要过滤,结合过滤装置选择仪器有普通漏斗、烧杯、玻璃棒,
故答案为:蒸发浓缩,降温结晶,过滤;玻璃棒;
(4)还原剂A可用SO2,二氧化硫具有还原性被铁离子氧化为硫酸,反应的离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续操作应除去过量的SO2以免影响后面Fe2+的测定,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;除去过量的SO2,以免影响后面Fe2+的测定;
(5)滴定实验反应终点的判断是依据高锰酸钾溶液滴入最后一滴溶液呈浅红色且半分钟不变化,从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.消耗高锰酸钾溶液体积第3次误差较大舍去,计算平均消耗溶液体积,结合离子反应的定量关系计算,V(标准)=
ml=20.00ml,铁元素守恒计算
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
5Li2FeSiO4~5Fe2+~MnO4-,
5 1
n 0.2000mol/L×0.020L
n=0.0200mol
100ml溶液中含物质的量=0.0200mol×
=0.1000mol,
产品中Li2FeSiO4的质量分数=
×100%=81%,
滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,会造成V(标准)偏大,会造成c(待测)偏高,
故答案为:溶液变为浅红色,且半分钟内不变色;81%;偏高;
故答案为:100ml容量瓶,酸式滴定管;
(2)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,因为亚铁离子具有还原性,易被氧化,所以惰性气体氛围中是为了防止亚铁离子被氧化,
故答案为:防止二价铁被氧化;
(3)操作Ⅱ是溶液中得到硫酸亚铁晶体的实验操作,蒸发浓缩,降温结晶,过滤洗涤得到;操作Ⅰ是分离固体和溶液的方法需要过滤,结合过滤装置选择仪器有普通漏斗、烧杯、玻璃棒,
故答案为:蒸发浓缩,降温结晶,过滤;玻璃棒;
(4)还原剂A可用SO2,二氧化硫具有还原性被铁离子氧化为硫酸,反应的离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续操作应除去过量的SO2以免影响后面Fe2+的测定,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;除去过量的SO2,以免影响后面Fe2+的测定;
(5)滴定实验反应终点的判断是依据高锰酸钾溶液滴入最后一滴溶液呈浅红色且半分钟不变化,从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.消耗高锰酸钾溶液体积第3次误差较大舍去,计算平均消耗溶液体积,结合离子反应的定量关系计算,V(标准)=
| 20.00+19.98+20.02 |
| 3 |
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
5Li2FeSiO4~5Fe2+~MnO4-,
5 1
n 0.2000mol/L×0.020L
n=0.0200mol
100ml溶液中含物质的量=0.0200mol×
| 100 |
| 20 |
产品中Li2FeSiO4的质量分数=
| 0.1mol×162g/mol |
| 20.00g |
滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,会造成V(标准)偏大,会造成c(待测)偏高,
故答案为:溶液变为浅红色,且半分钟内不变色;81%;偏高;
看了 新型电池在飞速发展的信息技术...的网友还看了以下:
工地运来一批钢材,其中圆形钢材2吨,方形钢材2吨,其他钢材5分之2吨.这批钢材一共有多少吨?水果店 2020-05-17 …
阅读下面的材料,写出你的发现和探究的结果.材料一:有一位经验丰富的老船长,当他的货轮卸货后在浩瀚阅 2020-06-20 …
(2011•嘉兴二模)果蝇是遗传学研究理想材料之一,通过诱发突变和人工选择可以培育许多新品种.请回 2020-06-27 …
材料一:“果粉”,指苹果公司数码产品的狂热爱好者。在中国就有着成千上万的“果粉”。2013年9月2 2020-07-06 …
18.阅读下面材料,按要求作文一枚果实孕育了三粒种子。果子成熟了,外壳开裂,它们要寻找各自的生活道 2020-07-12 …
有一堆钢材重112吨,用一辆卡车运正好14次运完,如果这辆车每次多运6吨,运336吨钢材,至少运多 2020-07-19 …
下面是一份有关尝试回忆效果的实验结果材料,试根据这个材料完成后面两题。(1)从表中数据的纵向对比过 2020-07-25 …
春砂仁主产于广东阳江等地,它的果实是中医常用的一味药材,也可用作调味品.春砂仁幼果发育过程中,落果率 2020-11-12 …
阅读下面的几段材料,从中你有什么发现?写出你探究的结果材料一:一分钱在许多地方已经失去人们的尊重,全 2020-12-10 …
阅读下列材料:材料一如果六十年代以来中国没有原子弹、氢弹,没有发射卫星,中国就不能叫有重要影响的大国 2020-12-12 …