早教吧作业答案频道 -->化学-->
磷酸铁(FePO4)为难溶于水的米白色固体,可用于制备药物、食品添加剂和锂离子电池的正极材料.实验室利用钛铁矿(主要成分为FeTiO3,含有少量MgO、CaO、SiO2等杂质)制备磷酸铁和锂离子
题目详情
磷酸铁(FePO4)为难溶于水的米白色固体,可用于制备药物、食品添加剂和锂离子电池的正极材料.实验室利用钛铁矿(主要成分为FeTiO3,含有少量MgO、CaO、SiO2等杂质)制备磷酸铁和锂离子电池正极材料(LiFePO4)的部分工业流程如图所示:
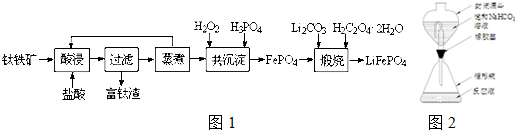
(1)富钛渣中的主要成分为TiO2和___(填化学式).煅烧得到LiFePO4的化学方程式为___.
(2)在共沉淀步骤中加入H2O2的目的是让滤液中的Fe2+完全被H2O2氧化.
①反应的离子方程式为___.
②下列实验条件控制正确的是___(填序号).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节pH=7
(3)已知Ca2+、Mg2+和Fe3+离子形成磷酸盐的Ksp分别为2.0×10-29、1.0×10-24和9.9×10-16,若溶液中三种金属阳离子的浓度均为0.1mol•L-1,则加入H3PO4时首先生成沉淀的化学式为___.
(4)制备LiFePO4的过程中,理论上所需 17%双氧水与H2C2O4•2H2O的质量比为___.
(5)钛铁矿中钛含量的测定步骤为:
①还原.将含钛试样溶解于强酸溶液中,再加入铝片将TiO2+还原为Ti3+,并将Fe3+还原.反应装置如图所示,使用封闭漏斗的目的是___.
②滴定.取下封闭漏斗,向锥形瓶中加入2~3滴KSCN溶液,立即用FeCl3 标准溶液滴定至终点,记录读数.
③计算.下列操作会导致测定结果偏低的是___.
a.还原操作结束后铝片有剩余
b.还原操作结束后,反应液仍呈黄色
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出.

(1)富钛渣中的主要成分为TiO2和___(填化学式).煅烧得到LiFePO4的化学方程式为___.
(2)在共沉淀步骤中加入H2O2的目的是让滤液中的Fe2+完全被H2O2氧化.
①反应的离子方程式为___.
②下列实验条件控制正确的是___(填序号).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节pH=7
(3)已知Ca2+、Mg2+和Fe3+离子形成磷酸盐的Ksp分别为2.0×10-29、1.0×10-24和9.9×10-16,若溶液中三种金属阳离子的浓度均为0.1mol•L-1,则加入H3PO4时首先生成沉淀的化学式为___.
(4)制备LiFePO4的过程中,理论上所需 17%双氧水与H2C2O4•2H2O的质量比为___.
(5)钛铁矿中钛含量的测定步骤为:
①还原.将含钛试样溶解于强酸溶液中,再加入铝片将TiO2+还原为Ti3+,并将Fe3+还原.反应装置如图所示,使用封闭漏斗的目的是___.
②滴定.取下封闭漏斗,向锥形瓶中加入2~3滴KSCN溶液,立即用FeCl3 标准溶液滴定至终点,记录读数.
③计算.下列操作会导致测定结果偏低的是___.
a.还原操作结束后铝片有剩余
b.还原操作结束后,反应液仍呈黄色
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出.
▼优质解答
答案和解析
钛铁矿(主要成分为FeTiO3,含有少量MgO、CaO、SiO2等杂质)用盐酸溶解后可以得到含有Ca2+、Mg2+、Fe2+、Fe3+的溶液和含有TiO2、SiO2的固体,过滤后在滤液中加入双氧水和磷酸,可得到FePO4固体,将FePO4、Li2CO3、H2C2O4•2H2O煅烧可得到LiFePO4,
(1)根据流程分析,SiO2是不溶于酸的,所以富钛渣中的主要成分是TiO2和SiO2,根据元素守恒可知煅烧得到LiFePO4的化学方程式为2FePO4+Li2CO3+H2C2O4•2H2O
2LiFePO4+3CO2↑+3H2O,
故答案为:SiO2;2FePO4+Li2CO3+H2C2O4•2H2O
2LiFePO4+3CO2↑+3H2O;
(2)①Fe2+与H2O2在酸性条件下发生氧化还原反应生成Fe3+和水,反应的离子方程式为2Fe 2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe 2++H2O2+2H+=2Fe3++2H2O;
②由于双氧水易受热分解,所以双氧水要适当过量,且加入的速度要慢,以防止反应过快,温度升高,Fe2+与H2O2在酸性条件下发生氧化还原反应,
故选AB;
(3)物质的Ksp越小,越容易形成沉淀,FePO4的Ksp为2.0×10-29是最小,所以Ca2+、Mg2+和Fe3+三种金属阳离子的浓度均为0.1mol•L-1时,加入H3PO4首先生成沉淀的化学式为FePO4,
故答案为:FePO4;
(4)根据电子得失守恒可知H2O2~2Fe3+,根据煅烧中的反应方程式可知2FePO4~H2C2O4•2H2O,所以H2O2~H2C2O4•2H2O,即H2O2和H2C2O4•2H2O的物质的量之比为1:1,所以17%双氧水与H2C2O4•2H2O的质量比为
:(100+36)=200:136=100:63,
故答案为:100:63;
(5)①Ti3+易被空气氧化,所以使用封闭漏斗的目的是避免生成的Ti3+被空气氧化,
故答案为:避免生成的Ti3+被空气氧化;
③a.还原操作结束后铝片有剩余,会多消耗FeCl3 标准溶液,会导致测定结果偏高;
b.还原操作结束后,反应液仍呈黄色,说明FeCl3 标准溶液不足,会导致测定结果偏低;
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出,溶液中部分Ti3+会被空气中的氧气氧化,会导致FeCl3 标准溶液消耗量偏少,会导致测定结果偏低;
所以操作会导致测定结果偏低的是bc,
故选bc.
(1)根据流程分析,SiO2是不溶于酸的,所以富钛渣中的主要成分是TiO2和SiO2,根据元素守恒可知煅烧得到LiFePO4的化学方程式为2FePO4+Li2CO3+H2C2O4•2H2O
| ||
故答案为:SiO2;2FePO4+Li2CO3+H2C2O4•2H2O
| ||
(2)①Fe2+与H2O2在酸性条件下发生氧化还原反应生成Fe3+和水,反应的离子方程式为2Fe 2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe 2++H2O2+2H+=2Fe3++2H2O;
②由于双氧水易受热分解,所以双氧水要适当过量,且加入的速度要慢,以防止反应过快,温度升高,Fe2+与H2O2在酸性条件下发生氧化还原反应,
故选AB;
(3)物质的Ksp越小,越容易形成沉淀,FePO4的Ksp为2.0×10-29是最小,所以Ca2+、Mg2+和Fe3+三种金属阳离子的浓度均为0.1mol•L-1时,加入H3PO4首先生成沉淀的化学式为FePO4,
故答案为:FePO4;
(4)根据电子得失守恒可知H2O2~2Fe3+,根据煅烧中的反应方程式可知2FePO4~H2C2O4•2H2O,所以H2O2~H2C2O4•2H2O,即H2O2和H2C2O4•2H2O的物质的量之比为1:1,所以17%双氧水与H2C2O4•2H2O的质量比为
| 34 |
| 17% |
故答案为:100:63;
(5)①Ti3+易被空气氧化,所以使用封闭漏斗的目的是避免生成的Ti3+被空气氧化,
故答案为:避免生成的Ti3+被空气氧化;
③a.还原操作结束后铝片有剩余,会多消耗FeCl3 标准溶液,会导致测定结果偏高;
b.还原操作结束后,反应液仍呈黄色,说明FeCl3 标准溶液不足,会导致测定结果偏低;
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出,溶液中部分Ti3+会被空气中的氧气氧化,会导致FeCl3 标准溶液消耗量偏少,会导致测定结果偏低;
所以操作会导致测定结果偏低的是bc,
故选bc.
看了 磷酸铁(FePO4)为难溶于...的网友还看了以下:
相同质量的油脂比蛋白质和糖类含的能量要高,这是因为()A.油脂是由C、H、O三种元素组成的B.油脂 2020-04-07 …
下列有关组成细胞的元素和化合物的说法,正确的是()A.淀粉和糖原的单体都是核糖B.蔗糖和乳糖水解的 2020-05-13 …
下列有关组成细胞的元素和化合物的说法中,正确的是A.淀粉和糖原的单体都是核糖B.蔗糖和乳糖水解的产 2020-05-13 …
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下 2020-05-15 …
单词和单词间不可告人的关系?我感觉opinion和pinion之间有什么不可告人的内在关系.为什么 2020-06-14 …
化学反应可视为旧键断裂和新键形成的过程.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键 2020-06-16 …
组成糖原和脂质的主要化学元素分别是()A.C、H、O和C、H、OB.C、H、O和C、H、O、NC. 2020-06-27 …
相同质量的脂肪比蛋白质和糖类含的能量要高,这是因为A脂肪中是由C,H,O三种元素组成的B脂肪中O元 2020-07-03 …
胡杨树有“英雄树”之美称,且这种树只生活在大漠荒原中,则组成胡杨树的元素和化合物中含量最多的分别是 2020-07-21 …
有关淀粉、蛋白质和脂肪的组成说法正确的是()A.三者组成元素相同B.淀粉和脂肪的组成元素相同C.三 2020-07-26 …